127. Polykondensation und Polyaddition
Polykondensation
Die Reaktion, bei der Monomere zu einem Polymer reagieren, nennt man Polykondensationsreaktion. Im Gegensatz zu den anderen Arten der Polymergewinnung (Polymerisation und Polyaddition) ist die Polykondensation eine Verkettungsreaktion, bei der ein kleines Molekül - meistens Wasser, manchmal aber auch niedere Alkohole oder Halogenwasserstoffe - bei der Verkettung zweier Monomere abgespalten wird.
Polymere, die durch Polykondensation entstehen, sind Polyamide, Polyester, Polycarbonate, Aminoplaste und Polysulfide.
Am bekanntesten sind die Polyamide Nylon und Perlon sowie die Polyester Diolen und Trevira, die als Kunstfasern in Kleidungsstücken in aller Welt Verbreitung fanden. Damit ein Monomer an der Reaktion teilnehmen kann, muss es mindestens zwei funktionelle Gruppen (mehrfunktionelle Moleküle) besitzen, die reaktionsfähig sind (z. B. –OH, –COOH, –CO, –NH2, …).
Aminoplaste und Phenoplaste
Harnstoff verbindet sich mit Formaldehyd unter dem Einfluß von Säure zu einem weißen Kunstharz. Wegen der Beteiligung der Aminogruppe —NH2 an seiner Bildung wird es zu den sog. Aminoplasten gerechnet. Der Großteil der Aminoplaste wird als Klebstoff in der Holzindustrie und als Isoliermaterial eingesetzt. Den bei weitem größten Anteil bilden die Harnstoff-Formaldehyd-Harze (Harnstoffharz, UF-Harze), bedingt durch ihren verbreiteten Einsatz in Holzwerkstoffen (beispielsweise als "Spanplattenleim" in Spanplatten). Aber auch in Haushaltsartikeln, Karosserieteilen, sowie Verpackungsmaterial finden sie Verwendung.
Phenoplaste sind Polykondensationsprodukte von Formaldehyd mit Phenol und seinen Derivaten. Phenoplaste zählen zu den ersten Kunststoffen. Einer der ersten im großen Maßstab produzierten Phenoplaste ist das 1907 von Leo Hendrik Baekeland erfundene Bakelit (ein Phenol-Formaldehyd-Harz), das jahrzehntelang in vielen Bereichen eingesetzt wurde und auch heute noch hergestellt wird. Auch bei der Entstehung von Phenoplasten wird als Nebenprodukt Wasser abgespalten. Phenoplaste bestehen wie die Aminoplaste aus stark vernetzten Makromolekülen, was sie zu harten und spröden Kunststoffen macht.
Synthesefasern
Geschichte der Textilfasern
Archäologische Funde deuten darauf hin, dass Menschen bereits vor 7000 Jahren Leinen aus Flachs herstellten. Nachdem der Chemiker Mathias Schweizer im Jahr 1857 entdeckte, dass eine Lösung von Kupferoxid-Ammoniak, das so genannte Schweizer Reagens, Cellulose auflöst, meldeten Max Fremery und Johann Urban 1897 ein Patent zur Herstellung von Fasern aus der so gelösten Cellulose an. Diese Kunstseidefasern, Cupro genannt, wurden in der Textilindustrie verwendet.
Da die Moleküle von Amino- und Phenoplasten viel zu sehr in sich vernetzt sind, um Fäden bilden zu können, konzentrierte man sich bei der Suche nach anderen Substanzen auf die Bildung von gestreckten Molekülen. Dies ist der Fall, wenn die an der Kondensation beteiligten funktionellen Gruppen die Enden der Ausgangsmoleküle besetzen.

Die erste vollsynthetische Faser, das Polyamid Nylon, wurde 1934 von Wallace Hume Carothers entwickelt. Polyamid 6.6 ist das Original-„Nylon“ und wird aus Hexamethylendiamin (HMD) und Adipinsäure hergestellt.
$ \mathrm {
\underbrace {
\cdots \ H_2N – (CH_2)_6 – NH_2}_{Hexamethyldiamin}
+
\underbrace {
HOOC – (CH_2)_4 – COOH}_{Adipinsäure}
+
\underbrace {
H_2N – \ (CH_2)_6 – NH_2 \ \cdots}_{Hexamethyldiamin}
}$
$ \mathrm {
\Large {\xrightarrow{-n \ H_2O}}
}$
$ \mathrm {
\underbrace {
\cdots – NH – \ (CH_2)_6 – NH – CO – (CH_2)_4 – CO – NH – (CH_2)_6 – NH – \ \cdots}_{{Nylon \ 6,6}}
}$
(Die Ziffern 6,6 bedeuten, dass die Monomeren dieses Nylons je 6 Kohlenstoffatome besitzen)
Orientierung der Fasern
Die Faser ist dem kompakten Werkstoff überlegen. Besonders der Effekt der Orientierung verleiht Fasern eine hohe Festigkeit und Elastizität. Werkstoffe mit langkettigen Molekülen wie Synthesefasern eignen sich besonders, um eine hohe Orientierung zu erzeugen.
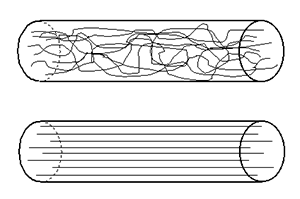
Geeignete Verfahren sind Spinnen und Verstrecken, so erhalten die aus Spinndüsen austretenden Fäden in einem nachfolgenden Streckprozess ihre Festigkeit und Elastizität. Die aus der Synthese ungeordnet hervorgegangenen Fadenmoleküle werden dabei parallel aneinander gelagert.
Fasern aus Polyester sind heute in der Textilindustrie nicht mehr wegzudenken.
$ \mathrm {
\cdots \ HO –
{\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}}
–
{\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}}
–
OH \ + \ HOOC
}$  $ \mathrm {
COOH +
HO –
{\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}}
–
{\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}}
–
OH \ \cdots
\ \xrightarrow{-n \ H_2O}
}$
$ \mathrm {
COOH +
HO –
{\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}}
–
{\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}}
–
OH \ \cdots
\ \xrightarrow{-n \ H_2O}
}$
Glykol Terephthalsäure
$ \mathrm {
\longrightarrow \cdotp \ O –
{\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}}
–
{\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}}
– O –
{\overset {\Large O} {\overset {\mid \mid} C}}
}$  $ \mathrm {
{\overset {\Large O} {\overset {\mid \mid} C}}
–
{\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}}
–
{\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}}
– O \cdotp \ \cdots
}$
$ \mathrm {
{\overset {\Large O} {\overset {\mid \mid} C}}
–
{\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}}
–
{\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}}
– O \cdotp \ \cdots
}$
Polyester (Trevira, Diolen)

Polyaddition
Die Polyaddition zeichnet sich dadurch aus, dass in vielstufigen, unabhängigen Einzelreaktionen Polymere "aneinander addiert" werden. Es reagieren Moleküle mit zwei funktionellen Gruppen ohne Abspaltung eines Nebenproduktes mit Molekülen, die reaktionsfähige H-Atome besitzen.
Da es sich um keine Gleichgewichtsreaktion handelt, kommt die Reaktion erst nach Verbrauch eines Reaktionspartners zum Stillstand. Die wichtigsten Kunststoffe, die durch Polyaddition entstehen, sind Polyurthane (PU) und Polyharnstoffe.
Polyurethane (PU) entstehen aus der Polyadditionsreaktion von Dialkoholen (Diolen) beziehungsweise Polyolen mit Polyisocyanaten. Polyole sind bei Raumtemperatur meist hochviskos (zähflüssig) bis fest. Dies liegt begründet in der Tatsache, dass sich Wasserstoffbrücken unter den einzelnen Molekülen ausbilden. Charakteristisch für Polyurethane ist die Urethan-Gruppe – NH – CO – O.
Bei Versuch 4 kommt es zu einer Addition von Diisocyanat mit einem Polyol, wobei der Kunststoff Polyurethan entsteht.
Durch den Einsatz verschiedener Polyolen, die sich im Verzweigungsgrad und in der Zahl der Hydroxygruppen im Molekül unterscheiden, können Polyurethane hart und spröde, aber auch weich und elastisch sein. Besonders die Elastomere weisen eine vergleichsweise hohe Reißfestigkeit auf. Durch CO2-Entwicklung infolge einer Reaktion des Polyisocyanats mit Wasser kommt es zur Schaumbildung. In aufgeschäumter Form ist Polyurethan als dauerelastischer Weichschaum (z. B. für Sportschuhsohlen) oder als harter Montageschaum bekannt.
