95. Alkohole - Gesetzmäßigkeiten innerhalb der homologen Reihe
Die homologe Reihe der Alkohole
Eine Homologe Reihe (griech. : homo, gleich, logos Sinn) ist eine Reihe von Stoffen, die sich über eine allgemeine Summenformel darstellen lässt und bei der ein Stoff dieser Reihe aus dem vorherigen Stoff durch „Hinzufügen“ eines weiteren „Kettengliedes“ gebildet wird. Durch Substitution eines Wasserstoffatoms beim Methan und beim Propan durch die Hydroxygruppe ergeben sich die entsprechenden Hydroxylderivate Methanol und Propanol.
$ \mathrm { {H \ –\ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ OH}_{Methanol} \qquad \qquad {H \ –\ {\overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; –\ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ OH }_{Propanol} } $
Der Name einfacher Alkohole ergibt sich als Zusammensetzung aus dem Namen des ursprünglichen Alkans, plus die Endung „-ol“. Zusätzlich wird die Position der OH-Gruppe durch eine vorangestellte Zahl verdeutlicht, zum Beispiel Propan-2-ol. Auch bei den Alkoholen findet man wie bei den Alkanen, Alkenen und Alkinen eine homologe Reihe, deren Summenformel CnH2n+lOH lautet. Die Alkohole sind also durch die Hydroxygruppe — OH gekennzeichnet.
Alkohole innerhalb der homologen Reihe - Verhalten
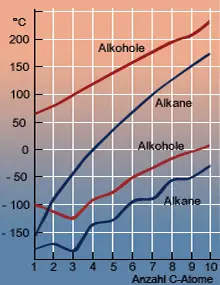
Erwartungsgemäß verhalten sich Methanol und Propanol in chemischer Hinsicht genau wie Ethanol. Schmelz- und Siedepunkte steigen innerhalb der homologen Reihe ebenfalls gesetzmäßig an.
Die Wasserlöslichkeit der niederen Alkohole beruht auf der Anwesenheit von Hydroxygruppen. Mit der Zunahme des Kohlenwasserstoffrestes tritt die Wirkung der wasserfreundlichen Hydroxygruppe jedoch zunehmend in den Hintergrund. Ab dem Butanol lösen sich die Alkohole immer schlechter in Wasser um schließlich vollkommen wasserunlöslich zu werden, wie beispielsweise der Cetylalkohol. Umgekehrt ist der wasserfeindliche Alkylrest der Grund für die Mischbarkeit der Alkohole mit den unpolaren Alkanen.

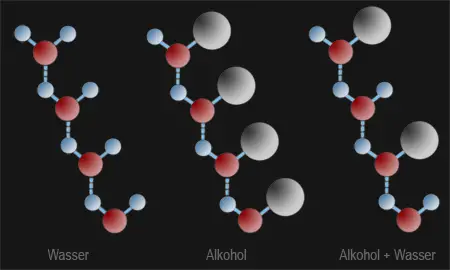
Verdünnt man reinen Alkohol mit Wasser, dann tritt eine Volumenverminderung ein. Diese Beobachtung weist ebenfalls auf Anziehungskräfte zwischen den Wasser- und Alkoholmolekülen hin, wodurch die Teilchen enger zusammenrücken. Dies kann man sich gut vorstellen, denn die kleineren Wassermoleküle füllen die Zwischenräume zwischen den größeren Alkoholmolekülen aus.
Die Hydroxygruppe ist nicht nur für das Lösungsverhalten der Alkohole verantwortlich, sondern auch für deren Aggregatzustand. Werden die Alkane nur durch die schwachen Van-der-Waals- Kräfte zusammengehalten, was sich im gasförmigen Zustand der ersten vier Alkane ausdrückt, verursacht die Polarisation der Hydroxygruppen zusätzliche Kräfte zwischen den Alkoholmolekülen (Wasserstoffbrückenbindung).
Die Wasserstoffbrückenbindung beruht darauf, dass ein freies Elektronenpaar am Sauerstoff der OH -Gruppe oder in H2O das wegen der Polarisierung der Bindung locker gebundene Wasserstoffatom der Hydroxygruppe eines benachbarten Alkoholmoleküls schwach bindet (Name!). Auch die H -Atome von Wassermolekülen können über Wasserstoffbrückenbindungen mit Sauerstoffatomen von anderen Wasser- oder Alkoholmolekülen gebunden werden (Bild 3). Dies erklärt die hohen Schmelz- und Siedepunkte der Alkohole. Durch diese Bindung werden Alkoholmoleküle stärker miteinander verknüpft als durch van der Waals'sche Kräfte.
Brennbarkeit der Alkohole
Alle Alkohole sind brennbar. Durch den Wassergehalt lassen sich bei der 30 - und 50%igen Ethanollösung die Alkohole erst nach Erhitzen, das zum Verdampfen des Alkohols führt, entzünden. Wie höhere Alkane brennen auch höhere Alkohole mit rußender Flamme.