102. Chemische Eigenschaften der Aldehyde und Ketone
Große Reaktionsfähigkeit
Alkanale (Aldehyde) und Alkanone (Ketone) sind wegen ihrer polarisierten CO-Gruppe besonders reaktionsfreudige organische Verbindungen. Sie sind sowohl bei großtechnischen Synthesen als auch bei chemischen Reaktionen in der lebenden Zelle häufige Vor- oder Zwischenprodukte. So setzt der Stoffwechsel eines gesunden Menschen im Laufe des Lebens ein bestimmtes Alkanal (Aldehyd) im Maßstab von einigen Tonnen um. Die Rede ist von dem Zucker Glucose oder Traubenzucker.
Additionsreaktion
Wegen ihrer C = O-Doppelbindung sind bei Aldehyden und Ketonen die Additionsreaktionen besonders ausgeprägt. So entstehen unter dem Einfluß von Katalysatoren durch Anlagerung von Wasserstoff (= Hydrierung) wieder Alkohole.
 $ \mathrm { \underbrace {H \ – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ \!\!\!\!\!\!\!\!\!\!\!\!\! {\overset { \qquad \ \ \qquad { \Large O}} {\overset {\qquad \ \diagup \!\! \diagup } {\underset {\qquad \qquad {\Large H} } {\underset {\qquad \diagdown }C }}}}}_{Ethanal} + H \ – \ H \xrightarrow {\lbrack \ Ni \ \rbrack \ } \underbrace {H \ – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} – { \overset {\Large {OH}} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ H}_{Ethanol} }$
$ \mathrm { \underbrace {H \ – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ \!\!\!\!\!\!\!\!\!\!\!\!\! {\overset { \qquad \ \ \qquad { \Large O}} {\overset {\qquad \ \diagup \!\! \diagup } {\underset {\qquad \qquad {\Large H} } {\underset {\qquad \diagdown }C }}}}}_{Ethanal} + H \ – \ H \xrightarrow {\lbrack \ Ni \ \rbrack \ } \underbrace {H \ – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} – { \overset {\Large {OH}} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ H}_{Ethanol} }$
 $ \mathrm { \underbrace {H \ – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ {\overset {\Large O} {\overset {||} C}} \; – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ H}_{Propanon} + H \ – \ H \;\; \xrightarrow {\lbrack \ Ni \ \rbrack \ } \;\; \underbrace {H \ – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ { \overset {\Large {OH}} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ H}_{2-Propanol} }$
$ \mathrm { \underbrace {H \ – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ {\overset {\Large O} {\overset {||} C}} \; – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ H}_{Propanon} + H \ – \ H \;\; \xrightarrow {\lbrack \ Ni \ \rbrack \ } \;\; \underbrace {H \ – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ { \overset {\Large {OH}} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ H}_{2-Propanol} }$
An Aldehyde und Ketone kann man neben Wasserstoff noch zahlreiche andere Verbindungen addieren, so zeigt Bild 2 unten eine Versuchsanordung, mit der Ammoniak an Ethanal addiert werden kann.
Polymerisationsreaktion
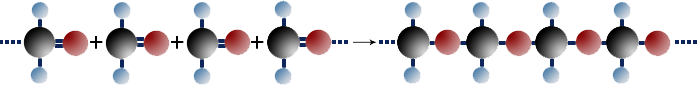
Durch Polymerisationsreaktionen vereinigen sich Aldehyde - wie die Alkene und Alkine - zu höhermolekularen Verbindungen. Ob nieder- oder hochmolekulare Verbindungen entstehen, hängt dabei in erster Linie von den Reaktionsbedingungen ab. So entsteht beim Erwärmen von Formaldehyd der feste, hochmolekulare Paraformaldehyd oder Polymethanal.
$ \mathrm { \cdots + \underbrace {H \ – \!\!\!\!\!\!\!\!\!\!\!\!\! {\overset { \qquad \ \ \qquad { \Large O}} {\overset {\qquad \ \diagup \!\! \diagup } {\underset {\qquad \qquad {\Large H} } {\underset {\qquad \diagdown }C }}}}}_{Methanal} \!\!\!\! + \; H \ – \!\!\!\!\!\!\!\!\!\!\!\!\! {\overset { \qquad \ \ \qquad { \Large O}} {\overset {\qquad \ \diagup \!\! \diagup } {\underset {\qquad \qquad {\Large H} } {\underset {\qquad \diagdown }C }}}} \!\!\!\! + \; H \ – \!\!\!\!\!\!\!\!\!\!\!\!\! {\overset { \qquad \ \ \qquad { \Large O}} {\overset {\qquad \ \diagup \!\! \diagup } {\underset {\qquad \qquad {\Large H} } {\underset {\qquad \diagdown }C }}}} \!\!\!\! + \; \cdots \ \longrightarrow \ \ \cdots \ \underbrace {{ \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ O \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ O \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ O \ }_{Polymethanal} \cdots }$
An Behältern mit Formaldehydlösungen bildet sich oft ein weißer Belag von Paraformaldehyd.
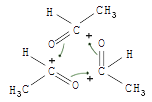
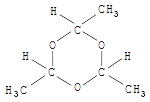
Versetzt man Acetaldehyd mit konz. Schwefelsäure, so bildet sich der niedermolekulare Paraldehyd. Dieser hat eine ringförmige Struktur:
|
$\longrightarrow$ |
|
||
| Acetaldehyd | Polymerisation | Paraldehyd | ||
| $\longrightarrow$ | ||||
Anders als Alkanale zeigen Alkanone keine Polymerisationsreaktionen.
Redoxreaktionen
Wenn man Fehlingsche Lösung mit Ethanal erhitzt, verschwindet schnell die tiefblaue Farbe und es bildet sich ein roter Niederschlag von Cu2O. Vereinfacht kann man die Reaktion so beschreiben:
Reduktion:
$ \mathrm { 2 \ Cu{(OH)}_2 \ \longrightarrow \ Cu_2O \ \downarrow + 2 \ H_2O + \ \langle O \rangle }$
Wenn Kupfer reduziert wird, muß ein anderer Reaktionspartner oxidiert werden. Bei diesem Beispiel kommt nur Ethanal dafür in Frage. Er wird zu Essigsäure oxidiert.
Oxidation:
$ \mathrm { CH_3CHO + \langle O \rangle \ \longrightarrow \ CH_3COOH }$
Acetaldehyd $\longrightarrow$ Essigsäure
Silberspiegel:
$ \mathrm { 2 \ {Ag}^+ + 2 \ OH^- + CH_3CHO \ \longrightarrow \ 2 \ Ag \ \downarrow + H_2O + CH_3COOH }$
Bei der Fehling-Probe und und der Silberspiegel- oder Tollensprobe die (Abscheidung eines Silberspiegels aus einer ammoniakalischen Silbernitratlösung) handelt es sich um wichtige Nachweisreaktionen in der organischen Chemie.
Allerdings sind sie keine speziellen Nachweisreaktionen für Alkanale, zeigen aber, dass sie in der —CHO -Gruppe eine reduzierende Gruppe besitzen. Diese wird zur COOH-Gruppe oxidiert. Die CO-Gruppe der Alkanone kann nicht weiter oxidiert werden. Sie zeigen keine Polymerisation und keine Redoxreaktion.