126. Kunststoffe durch Polymerisation
Begriff
Die Polymerisation (korrekt: Kettenpolymerisation) ist eine Sammelbezeichnung chemischer Reaktionen, bei denen gleiche oder unterschiedliche Monomere über ein Kettenwachstum zu Polymeren reagieren. Bei der Wachstumsreaktion erfolgt eine fortlaufende Anlagerung der meist ungesättigten organischen Monomere an die wachsende Kette.
Polymere - Kunststoffe aus Alkenen
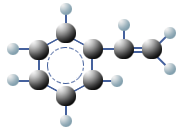
Polymere sind große Moleküle, die sich aus vielen kleinen Molekülen, den Monomeren zusammensetzen. Die gesamte belebte Natur ist voll von Polymeren. Beispielsweise sind Zellulose und Stärke aus Glucose-Molekülen aufgebaut und bei den komplexen Proteinen sind Aminosäuren die Monomere. Monomere von Kunststoffen sind fast immer kleine und einfache organische Moleküle mit einer reaktionsfähigen Doppelbindung oder mit funktionellen Gruppen (Vinylgruppe). Als Vinylgruppe bezeichnet man in der organischen Chemie den sehr reaktionsfähigen Ethen-Rest (früher: Ethylen-Rest), also die Atomgruppe R–CH=CH2. Bei einer Polymerisierung entsteht Polyethylen (PE).
.jpg)
Wird Propen polymerisiert, entsteht Polypropylen (PP) und mit Styrol als Monomer entsteht Polystyrol (PS).
Vom Styrol zum Polystyrol
Das Monomer des Kunststoffs Polystyrol ist der ungesättigte Kohlenwasserstoff Vinylbenzol (C6H5CH=CH2), der Styrol genannt wird.
C6H5CHCH2.
Die Polymerisationseigenschaften des Styrols sind außergewöhnlich: Es geht thermische, radikalische, koordinative, anionische sowie kationische Polymerisationen ein. So kann zum Beispiel für eine kationische Polymerisation dem Styrol Eisenchlorid zugegeben werden. Wenn das Styrol nun mithilfe eines Bunsenbrenners zum Sieden gebracht wird, kann es aus der Flamme genommen werden und es reagiert von alleine zu Polystyrol weiter.
Bei der thermischen Polymerisation wird Styrol einfach der Hitze ausgesetzt. Bei der radikalischen Polymerisation verbindet sich ein Radikal mit dem Styrol, dadurch wird das Styrol selbst zum Radikal, diese Radikale können nun polymerisieren, als Radikalstarter werden häufig organische Peroxide wie das Dibenzoylperoxid verwendet. Diese Radikale greifen das Styrol an der Doppelbindung an und sprengen diese (Startphase). Dabei entstehen Molekülbruchstücke mit je einem freien Elektron.
Für die Molekülbruchstücke (Radikale) schreibt man nur $ \mathrm R \cdotp $.
Startphase:
$ \mathrm { \underbrace {R \cdotp}_{Radikal} + \quad \underbrace { {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ \ = \! {\overset {\Large H} {\overset {\mid} {\underset {\Large {C_6H_5}} {\underset {\mid} C}}}}}_{Styrol} \ \longrightarrow \quad \underbrace { R \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ \ – \! {\overset {\!\! \Large H} {\overset {\!\! \mid} {\underset {\Large {C_6H_5}} {\underset {\mid} C \cdotp}}}}}_{Radikal} }$
Das bei der Startreaktion gebildete Radikal verbindet sich mit einem Styrolmolekül unter Aufhebung der Doppelbindung. Der Vorgang wiederholt sich, und aus einem niedermolekularen Produkt wird ein höhermolekulares (Polymerisation), das ein Kohlenstoffatom mit einem freien Elektron (Radikal!) besitzt. Den Vorgang der Kettenverlängerung nennt man Wachstumsphase.
Wachstumsphase:
$ \mathrm { R \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ \ – \! {\overset {\!\! \Large H} {\overset {\!\! \mid} {\underset {\Large {C_6H_5}} {\underset {\mid} C \cdotp }}}} \ + \quad {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ \ = \! {\overset {\Large H} {\overset {\mid} {\underset {\Large {C_6H_5}} {\underset {\mid} C}}}} \ \longrightarrow \quad R \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ \ – \! {\overset {\Large H} {\overset {\mid} {\underset {\Large {C_6H_5}} {\underset {\mid} C}}}} \! – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ \ – \! {\overset {\!\! \Large H} {\overset {\!\! \mid} {\underset {\Large {C_6H_5}} {\underset {\mid} C \cdotp }}}} }$
Erst wenn zwei Radikale aufeinandertreffen, kommt es zum Abbruch des Kettenwachstums und die Polymerisation ist beendet.
Abbruchphase:
$ \mathrm { R \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ \ – \! {\overset {\Large H} {\overset {\mid} {\underset {\Large {C_6H_5}} {\underset {\mid} C}}}} \! – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ \ – \! {\overset {\!\! \Large H} {\overset {\!\! \mid} {\underset {\Large {C_6H_5}} {\underset {\mid} C \cdotp }}}} + \quad R \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ \ – \! {\overset {\!\! \Large H} {\overset {\!\! \mid} {\underset {\Large {C_6H_5}} {\underset {\mid} C \cdotp }}}} \ \longrightarrow \quad R \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ \ – \! {\overset {\Large H} {\overset {\mid} {\underset {\Large {C_6H_5}} {\underset {\mid} C}}}} \! – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ \ – \! {\overset {\Large H} {\overset {\mid} {\underset {\Large {C_6H_5}} {\underset {\mid} C}}}} \! – \! {\overset {\Large H} {\overset {\mid} {\underset {\Large {C_6H_5}} {\underset {\mid} C}}}} \! – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ – \ R }$
In vereinfachter Form lässt sich die Polymerisation des Styrols so formulieren:
$ \mathrm { \underbrace { n \ C_6H_5 – CH = CH_2}_{Styrol} \xrightarrow{Aktivator \ } \ \underbrace { {\Large \lbrack} C_6H_5 – {\overset {\Large \cdotp} {\overset {\Large \ }{CH}}} – {\overset {\Large \cdotp} {\overset {\Large \ } {CH_2}}} {\Large \rbrack}_n}_{Polystyrol} }$
Wesentlich für die Polymerisation ist, dass sich bei der Wachstumsreaktion fortlaufend meist ungesättigte organische Monomere an die wachsende Kette anlagern. Dabei findet weder eine Abspaltung von Nebenprodukten, noch eine Wanderung von Molekülgruppen innerhalb der Reaktanden statt. Meist handelt es sich bei den Monomeren um Derivate des Ethens mit der allgemeinen Formel CH2 = CHx (x könnte z.B. Cl, CN oder C6H5 sein).
Plexiglas wird depolymerisiert
Plexiglas (Polymethylmethacrylat, kurz PMMA) wurde 1928 entwickelt und 1933 zur Marktreife gebracht. Heute wird es in großen Mengen für unzählige Anwendungen hergestellt. Die ersten Kontaktlinsen aus Kunststoff wurden etwa 1939 aus PMMA hergestellt. Außerdem findet der Stoff in der Medizin Einsatz als sog. Knochenzement zur Stabilisierung von Implantaten im Knochen. PMMA entsteht durch Polymerisation des monomeren Methacrylsäuremethylesters.
$ \begin{array}{c} \mathrm { H } \\ \mid \\ \mathrm { C } \\ \mid \\ \mathrm { H } \\ \end{array} \overset {\Large —} — \ \begin{array}{l} \mathrm { \!\! CH_3 } \\ \mid \\ \mathrm { \!\! C } \\ \mid \\ \mathrm { \!\! COOCH_3 } \\ \end{array} $
Wie der Geruchsvergleich und die Bromwasserreaktion zeigen, entsteht beim Erhitzen von Plexiglas wieder der Methacrylsäuremethylester. Der Versuch 2 entspricht der Zerlegung des Plexiglases in seine Monomere. Den Vorgang nennt man Depolymerisation.
$ \mathrm { \left \lbrack \cdotp \ \begin{array}{c} \mathrm { H } \\ \mid \\ \mathrm { C } \\ \mid \\ \mathrm { H } \\ \end{array} — \begin{array}{l} \mathrm { \!\! CH_3 } \\ \mid \\ \mathrm { \!\! C \cdotp } \\ \mid \\ \mathrm { \!\! COOCH_3 } \\ \end{array} \right \rbrack_n {\overset {Depolymerisation} {\underset {Polymerisation} {\Large \rightleftharpoons}}} \quad n \ \begin{array}{c} \mathrm { H } \\ \mid \\ \mathrm { C } \\ \mid \\ \mathrm { H } \\ \end{array} \overset {\Large —} — \begin{array}{l} \mathrm { \!\! CH_3 } \\ \mid \\ \mathrm { \!\! C } \\ \mid \\ \mathrm { \!\! COOCH_3 } \\ \end{array} }$