111. Der Waschvorgang
Wasser ist zwar in der Natur das wichtigste Lösemittel, doch in einem modernen Haushalt reicht seine Reinigungswirkung bei weitem nicht aus. Erst in Verbindung mit Seifen oder anderen Waschmitteln erreicht man die gewünschte Wirkung.
Oberflächenspannung des Wassers
Welche Auswirkungen die Oberflächenspannung des Wassers hat, ist uns aus der Natur und dem Haushalt wohlbekannt (Bild 1).
Wenn man eine flache Rasierklinge auf eine stille Wasseroberfläche (beispielsweise in einem Glas) auflegt, so geht sie nicht unter, sondern schwimmt oben auf. Erst wenn man etwas Seifenlösung in das Glas gibt, geht die Rasierklinge unter. Wie kann man sich dieses Phänomen erklären?
Im Wasser ist jedes Molekül von Nachbarmolekülen umgeben. Die Anziehungskräfte zwischen den Teilchen heben sich daher auf (Bild 2). Anders verhält es sich bei den an der Oberfläche befindlichen Teilchen: Hier sind die zwischenmolekularen Kräfte nur nach innen wirksam. Das Wasser - wie auch andere Flüssigkeiten - ist daher bestrebt, eine möglichst kleine Oberfläche einzunehmen, was man unter anderem an der Tropfenbildung des tropfenden Wasserhahns erkennen kann. Wasser weist - bedingt durch den Dipolcharakter seiner Moleküle - eine vergleichsweise große Oberflächenspannung auf, da sich die Wassermoleküle gegenseitig relativ stark anziehen.
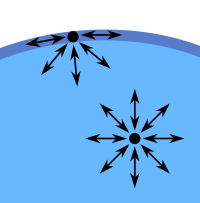
Die Oberflächenspannung beträgt etwa 73 mN/m bei 20 °C und nimmt bei zunehmender Temperatur ab. Wegen der großen Oberflächenspannung können sich beispielsweise Wasserläufer auf dem Wasser bewegen, jedoch wird das Eindringen in das zu waschende Gewebe (Benetzung), eine wichtige Voraussetzung für die Auflösung des Schmutzes, sehr behindert.
Herabsetzen der Oberflächenspannung und Benetzbarkeit
Bei Waschvorgängen ist Oberflächenspannung hinderlich, weshalb in Waschmitteln grenzflächenaktive Stoffe (Tenside) enthalten sind, die die Oberflächenspannung senken. Auch durch Zugabe von Seife wird die Oberflächenspannung stark herabgesetzt. Mit der Abnahme der Oberflächenspannung steigt auch das Benetzungsvermögen des Wassers an. Bringt man beispielsweise einen Tropfen Wasser auf Wolle, so dringt er nicht sofort in die Faser ein. Tropft man aber Seifenlösung darauf, so erkennt man, dass diese im Gegensatz zu Wasser rasch eindringt. Diese Wirkung der Seife lässt sich aus dem Bau der Seifenanionen verstehen:
$ \mathrm { H \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ – \ {\overset {\Large H} {\overset {\mid} {\underset {\Large H} {\underset {\mid} C}}}} \ – \!\!\!\!\!\!\!\!\!\!\!\!\! {\overset { \qquad \ \ \qquad { \Large O}} {\overset {\qquad \ \diagup \!\! \diagup } {\underset {\qquad \qquad {\Large O^-} } {\underset {\qquad \diagdown }C }}}} }$

Die beim Lösen der Seife entstehenden Fettsäurerestionen weisen einen unpolaren, wasserfeindlichen Alkylrest und eine polare, wasserfreundliche Gruppe auf. Diese Seifenanionen reichern sich an der Oberfläche so an, dass der hydrophile Kopf im Wasser steckt, während der hydrophobe Teil aus dem Wasser herausragt. Die Oberfläche wird nun von unpolaren Gruppen gebildet, zwischen denen wesentlich geringere Anziehungskräfte bestehen: Die Oberflächenspannung wird geringer. Wenn eine Seifenlösung mehr Seife enthält, als an der Oberfläche Platz ist, bilden die Seifenmoleküle in der Flüssigkeit größere Verbände, die so genannten Mizellen. Diese stehen nun für den Waschvorgang zur Verfügung.
Ablösung und Zerteilung des Schmutzes
In früheren Jahrhunderten erfolgte die Schmutzablösung durch harten körperlichen Einzatz, denn die Wäsche musste mittels Wäschestampfern oder Waschbrettern mechanisch behandelt werden. Heute wird der größte Teil des Waschvorgangs durch die Waschmittel selbst bewerkstelligt, unterstützt durch Wäsche schonende Waschmaschinen.
Schmutz ist ein Gemenge aus ganz unterschiedlichen Stoffen. Er besteht meist aus festen Partikeln, die zusammen mit Fett und Schweiß auf dem Gewebe haften (siehe Tabelle oben).
Wenn die Faser benetzt ist, strebt der wasserfeindliche Teil des Seifenmoleküls vom Wasser weg und tritt mit dem meist unpolaren Schmutz in Wechselwirkung. Die Seifenmoleküle dringen dabei in alle kapillaren Hohlräume ein. Sie müssen den Schmutz in kleinere Bruchstücke zerlegen, diese ganz einhüllen und bis zur Spülung in der Schwebe halten.
| Menge (%) | Art der Bestandteile | Entfernbarkeit |
|---|---|---|
| 15 - 20 |
Kochsalz |
wasserlöslich, leicht entfernbar |
| 5 - 7 |
Harnstoff |
|
| 20 - 25 | Eiweiß (Hautschuppen. . . ) | wasserunlöslich, grobteilig, leicht entfernbar |
| ca. 20 | Kohlenhydrate (Stärke, Faserreste. . ) | |
| 5 - 10 | Fett, Wachse, Kohlenwasserstoffe | wasserunlöslich, feinteilig schwer entfernbar |
| 25 - 30 | Pigmente (Ruß, Carbonate, Silicate. . . . ) |
Keine erneute Schmutzablagerung
Seifen lösen sich nicht richtig in Wasser, sondern bilden sogenannte Mizellen. In reinem Wasser sind die Mizellen sehr klein und nicht zu sehen. Im Inneren dieser kleinsten „Tröpfchen“ befinden sich die langen, unpolaren Kohlenwasserstoffketten, während die polaren Enden in das Wasser hinausragen. Durch die Ladungen, die auf den Enden sitzen, wird ein Zusammenballen der Mizellen und das Wiederabsetzen des Schmutzes und das Zusammenfließen der Fettröpfchen (emulgierende Wirkung) verhindert.

