55. Kalkgehalt des Wassers - Wasserhärte
Wasserhärte
Die Wasserhärte entsteht, wenn das Regenwasser durch Böden sickert. Deshalb hängt es stark vom geologischen Untergrund ab, welche und wie viel Härtebildner in Lösung gehen können. Magnesium- und Calciumionen können am einfachsten durch den Lösungsvorgang in das Wasser gelangen, etwa durch die Auflösung von Gips (CaSO4 × 2 H2O).
Der überwiegende Teil der Wasserhärte entsteht jedoch normalerweise als »Carbonathärte« durch Auflösung von Kalk (CaCO3) durch Kohlensäure unter Bildung löslicher Hydrogencarbonate (HCO3−). Das Kohlenstoffdioxid stammt überwiegend aus der Atmung der Organismen im Boden, wo vor allem der mikrobielle Abbau organischer Substanzen für eine hohe CO2 - Konzentration verantwortlich ist.
Die Auflösung reinen Kalksteins kann folgendermaßen formuliert werden:
$ \mathrm{CaCO_3 + CO_2 + H_2O \longrightarrow Ca^{2+} + 2 \ HCO_3^-} $
Calciumhydrogencarbonat und Calciumcarbonat
In Versuch Versuch 4 wird mit Kalkwasser der Nachweis von Kohlenstoffdioxid durchgeführt. Wenn man längere Zeit Kohlenstoffdioxid in Kalkwasser leitet, dann verschwindet die Trübung wieder, weil Calciumcarbonat mit Kohlensäure wasserlösliches Calciumhydrogencarbonat bildet.
$ \mathrm { CaCO_3 + H_{2}CO_{3} \ \leftrightharpoons \ Ca^{2+}_{(aq)} \ + 2 \ HCO_{3}^{-} } $
Calciumhydrogencarbonat (löslich)
Dieser Vorgang kann mit einer Messung der Leitfähigkeit beobachtet werden: Kalkwas
ser leitet den Strom gut, Calciumcarbonat leitet ihn nicht, und Calciumhydrogencarbonatlösung leitet ihn verhältnismäßig gut.
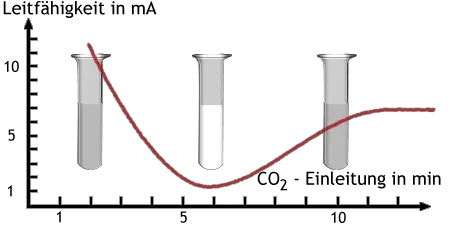
Änderung der elektrischen Leitfähigkeit beim Einleiten von CO2 in Kalkwasser.
Aufgrund des Verlaufs der Leitfähigkeitsmessung muß man annehmen, dass zu keinem Zeitpunkt alles Ca2+ und CO32− ausgefällt ist.
Beim Erhitzen einer Calciumhydrogencarbonat-Lösung fällt wieder Calciumcarbonat aus. Aus der vorigen Gleichung sieht man, dass Ca(HCO3)2 mit CaCO3 / H2CO3 im Gleichgewicht steht. Durch Erhitzen wird die Kohlensäure aus dem Gleichgewicht entfernt:
$ \mathrm { H_{2}CO_{3} \ \xrightarrow{Hitze} \ H_{2}O \ + \ CO_{2} \ \uparrow } $
Deshalb muß sich das Gleichgewicht beim Erhitzen nach links verschieben. Dies führt zu einer Abscheidung von Calciumcarbonat:
$ \mathrm { CaCO_3 + H_{2}CO_{3} \ \overset{H_2O}\leftrightharpoons \ Ca^{2+}_{(aq)} \ + 2 \ HCO_{3 \ (aq)}^{-} } $
Die Auflösung von Kalkstein in der Natur
Das Trinkwasser vieler Städte ist »kalkhaltig«. Die chemischen Vorgänge, die diesen Kalkgehalt verursachen, kennen wir schon (siehe oben!).
Kohlensäurehaltiges Wasser löst beim Sickern durch Kalksteinschichten langsam CaCO3 auf und bildet Ca(HCO3)2: der Kalkstein »verwittert«. Risse und Spalten werden dabei vergrößert. Verdunstet das kalkhaltige Wasser, so bildet sich Calciumcarbonat zurück. Darauf beruht die Bildung von Tropfsteinen.
Die Härte des Wassers
Kalkhaltiges Wasser nennt man »hartes Wasser«. Man unterscheidet zwischen vorübergehender oder temporärer und bleibender oder permanenter Härte des Wassers. Erstere wird durch Hydrogencarbonate, letztere vor allem durch Sulfate verursacht. Die Bezeichnung nimmt auf die Ausfällung der Hydrogencarbonate beim Erhitzen Bezug, wodurch das Wasser »enthärtet« wird.
Gesamthärte
Die Gesamthärte des Wassers gibt die Summe der Konzentrationen der Kationen von Erdalkalimetallen im Wasser an. Diese Kationen haben eine große, positive physiologische Bedeutung, allerdings stören sie bei einigen chemisch-physikalischen Prozessen, bei denen Wasser verwendet wird. Beispielsweise bilden Seifen mit diesen Kationen unlösliche Kalkseifen, die über keinerlei Reinigungswirkung mehr verfügen. Beim Waschen von Textilien in Wasser mit hoher Gesamtwasserhärte führen die Kalkseifen zu einer Verunreinigung der Textilen. Seifen zählen zu den anionischen Tensiden und sind besonders empfindlich gegenüber hartem Wasser. Die Waschleistung von anderen, modernen Tensiden in Waschmitteln wird dagegen kaum von der Wasserhärte beeinträchtigt.
Carbonat-Härte
In Bezug auf die Wasserhärte ist die Konzentration des Hydrogencarbonats (HCO3−) von spezieller Bedeutung. Man bezeichnet die Konzentration an Hydrogencarbonationen als Carbonat-, temporäre oder vorübergehende Härte. Ein Wasser befindet sich im sogenannten Kalkkohlensäure-Gleichgewicht, wenn es genau so viel Kohlenstoffdioxid enthält, dass es gerade keinen Kalk abscheidet, aber auch keinen Kalk lösen kann. Wird einem solchen Wasser Kohlenstoffdioxid entzogen, bilden sich schwer lösliche Verbindungen wie Calcit und Dolomit als besonders schwer lösliches Mischcarbonat (Kesselstein, Seekreide). Aufgrund der Temperaturabhängigkeit dieses Gleichgewichtssystems bilden sich auch Ablagerungen bei der Bereitung von Heißwasser (Warmwasseranlagen, Kaffeemaschinen, Kochtöpfe). In den Gewässern findet ein entsprechender Prozess als biogene Entkalkung in Folge des durch die Photosynthese von Wasserpflanzen und Planktonalgen verursachten Verlustes an Kohlenstoffdioxid statt.
Nichtcarbonat-Härte
Als Nichtcarbonat-, permanente oder bleibende Härte bezeichnet man den Teil der Gesamtwasserhärte, der nicht an Hydrogencarbonat bzw. Carbonat gebunden ist und daher prinzipiell nicht als Calcium- oder Magnesiumcarbonat aus dem Wasser entfernt werden kann. Dieser nicht entfernbare Anteil ist durch Anionen wie z. B. Chloride, Nitrate und Sulfate ausgeglichen („gebunden“).
Oft werden auch die Konzentrationen von Magnesium- und Calciumionen getrennt bestimmt und dann als „Magnesiumhärte“ bzw. „Calciumhärte“ bezeichnet. Ihre Summe entspricht in guter Näherung der Gesamtwasserhärte.
Hartes Wasser durch sauren Regen
Daneben können auch die in sauren Niederschlägen enthaltenen Säuren, die durch den Begriff saurer Regen bekannt geworden sind, ebenfalls zu einem Härteanstieg des Wassers führen. Beteiligt sind vor allem Schwefelsäure (H2SO4), die über Schwefeldioxid und die Bildung von Schwefliger Säure bei der Verbrennung schwefelhaltiger Brennstoffe entsteht, und Salpetersäure (HNO3), die über die Zwischenstufe der Stickoxide bei besonders heißen Verbrennungen gebildet wird. Durch Maßnahmen zur Luftreinhaltung (z. B. Rauchgasentschwefelung und Auspuffkatalysatoren) konnten diese Umweltprobleme in den vergangenen Jahrzehnten drastisch reduziert werden.
