94. Ethanol und der Versuch einer Strukturaufklärung
Ermittlung der Summenformel chemischer Verbindungen
Bei der Untersuchung von Stoffen wenden Chemikerinnen und Chemiker und Chemiker qualitative und quantitave Analyseverfahren an, die in heutigen Labors in der Regel von hochtechnischen Geräten erledigt werden. Diese können auch den Mengenanteil der Elemente in den Verbindungen und ihre Molekülmasse feststellen, was für das Ethanol die Summenformel C2H6O ergibt. Einfache Versuche zur Feststellung der elementaren Zusammensetzung von organischen Verbindungen beschreibt Kapitel 73.
Die Frage nach der Struktur des Ethanols
Man weiß, dass es Verbindungen gibt, die zwar die Gleiche Anzahl und Art von Atomen haben, jedoch sind diese unterschiedlich angeordnet. Sie haben also die gleiche Summenformel, sind aber unterschiedlich aufgebaut. Diese Tatsache bezeichnet man in der Chemie als Isomerie. Wenn man davon ausgeht, dass C vierwertig, H einwertig und O zweiwertig ist, dann lassen sich für das Ethanol, C2H6O, zwei verschiedene Strukturformeln aufstellen:
$ \mathrm { H \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ { \overset {\Large H} {\overset {|} {\underset {\Large H} {\underset {|}{C}}}}} \ – \ O \ – \ H } $
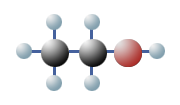
$ \mathrm { H \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ O \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ H } $
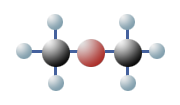
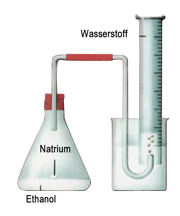
Welche Struktur trifft nun für das Ethanol zu? Um das herauszufinden, werden die Eigenschaften dieses Alkohols untersucht und die theoretisch möglichen Strukturen mit den Ergebnissen verglichen. Dadurch kann man diejenige Struktur ermitteln, die mit den festgestellten Eigenschaften am besten übereinstimmt. Bei der Durchführung von Versuch 1 gibt die Reaktion von Ethanol mit Natrium den entscheidenden Hinweis. Wenn man diese Reaktion quantitativ analysiert, dann findet man heraus dass ein Sechstel des im Ethanol enthaltenen Wasserstoffs freigesetzt wird. Das weist auf die Sonderstellung eines der sechs H-Atome im Molekül hin, die nur bei einer der beiden Strukturformeln gegeben ist: Natrium ersetzt das an Sauerstoff gebundene Wasserstoffatom.
$ \mathrm { \underbrace {H \ – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ OH}_{Ethanol} + Na \longrightarrow \underbrace {H \ – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ ONa}_{Natriumethylat} + \frac {1}{2} \ H_2 \ \uparrow } $
Die Hydroxygruppe ist eine funktionelle Gruppe
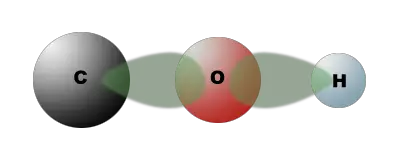
Wenn man die Elektronenverteilung betrachet, dann wird die erhöhte Reaktionsbereitschaft dieses Wasserstoffatoms klar. Das Sauerstoffatom zieht die Bindungselektronen stark an, wodurch eine polare Atombindung entsteht:
$ \mathrm {– \ { \overset | { \underset | C}} \ \blacktriangleleft \ O \ \blacktriangleright \ H } $
Dadurch ist das Wasserstoffatom weniger fest gebunden und kann vom Natrium aus der Verbindung verdrängt werden.
C2H5OH
Die Prüfung mit Indikatoren (Versuch 3 unten) zeigt, dass es in Wasser weder zur Abspaltung von H+ -Ionen noch von OH— -Ionen kommt. Um die Hydroxid-Ionen der Laugen davon zu unterscheiden, bezeichnet man die alkoholische OH-Gruppe als Hydroxygruppe. Diese darf also nicht mit dem negativ geladenen OH-Ion verwechselt werden. Neben der Reaktion mit Alkalimetallen ist diese funktionelle Gruppe noch Ursache für andere typische Eigenschaften des Ethanols, beispielsweise für seine Wasserlöslichkeit (s. Kapitel 95) und die Reaktion mit oxidiertem Kupfer. Taucht man heißes Kupferoxid in Ethanol, entsteht wieder rotes Kupfer. Dabei wird der Alkohol zu Ethanal (Acetaldehyd) oxidiert, einer stechend riechenden Verbindung. Ethanol zeigt also reduzierende Eigenschaften.
$ \mathrm { \underbrace {H \ – { \overset {\Large H} {\overset {|} { \underset{\Large H} {\underset {|}{C}}}}} \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ O \ – \ H}_{Ethanol} + CuO \ \longrightarrow \ Cu + H_2O + \underbrace {H \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \!\!\!\!\!\!\!\!\!\!\! {\overset { \qquad \ \ \qquad { \Large O}} {\overset {\qquad \ \diagup \!\! \diagup } {\underset {\qquad \qquad {\Large H} } {\underset {\qquad \diagdown }C }}}}}_{Acetaldehyd} } $