112. Seife und andere waschaktive Substanzen
Als Textilienwaschmittel haben Seifen ihre Bedeutung nahezu verloren, da sich durch die Wasserhärte unlösliche, flockige bis klebrige Calcium- und Magnesiumsalze der Fettsäuren bilden. Außerdem sind Seifen nur im basischen Bereich waschaktiv, was Textilfasern belasten kann. In heutigen Waschmitteln werden sie nur noch eingesetzt, um durch Bildung von Kalkseifen starkes Schäumen zu verhindern. Seifen haben heute fast nur noch Bedeutung im Bereich der Körperpflege.
Alkalische Reaktion von Seifenlösung
Versuch 1 zeigt, dass Lösungen von Seife in Alkohol oder Benzin neutral reagieren. Die alkalische Reaktion der Seife tritt erst bei Anwesenheit von Wasser auf und es kommt zu einem Protonenübergang auf die Seifenanionen (Protolyse):
$\mathrm { C_{17}H_{35}COO^-_{(aq)} + {Na}^+_{(aq)} + HOH \overset {H_2O} {\large \leftrightharpoons} \ C_{17}H_{35}COOH \ \downarrow + {Na}^+_{(aq)} \ + OH^-_{(aq)} }$
Die entstehenden wasserunlöslichen Fettsäuren verursachen eine deutliche Trübung der Seifenlösung, und die im Überschuß vorhandenen Hydroxid-Ionen haben eine typische laugenhafte Wirkung: es wird nicht nur der Schmutz entfernt, sondern auch ein Teil des natürlichen Fettfilmes der Haut. Dies kann bei zu häufigem Waschen zu rissiger, rauer Haut führen. Auch bestimmte Textilgewebe wie Wolle können beschädigt werden.
Auch bei Zugabe von Säuren bilden sich aus einer Seifenlösung Fettsäuren:
$\mathrm { C_{17}H_{35}COO^-_{(aq)} + H^+_{(aq)} \ \overset {H_2O} {\large \leftrightharpoons} \ C_{17}H_{35}COOH \ \downarrow }$
Diese Säureempfindlichkeit der Seife verhindert ihre Wirksamkeit in saurer Lösung.
Seife und hartes Wasser
In hartem Wasser - mit seinen vielen Calcium- und Magnesiumionen - hat Seife noch ungünstigere Eigenschaften. Es bilden sich unlösliche Calcium- und Magnesiumsalze der Fettsäuren, die so genannten Kalkseifen:
$\mathrm { 2 \ C_{15}H_{31}COO^-_{(aq)} + {Ca}^{\, 2+}_{(aq)} \ \overset {H_2O} {\large \leftrightharpoons} \ (C_{15}H_{31}COO)_2Ca \ \downarrow }$
Dadurch geht der entsprechende Seifenanteil für den Waschvorgang verloren und es kommt zu einer Verkrustung und Vergrauung des Gewebes. Die in hartem Wasser gewaschenen Textilien werden durch die ausfallenden unlöslichen Kalkseifen hart, fühlen sich kratzig an und sind unansehnlich.
Zur Textilreinigung sowohl im Haushalt als auch in Gewerbebetrieben verwendet man heute keine Seife mehr, sondern andere waschaktive Substanzen (WAS) oder Tenside.
Synthetische Waschrohstoffe - Tenside
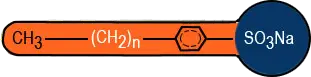
Schon bald nachdem man den Zusammenhang zwischen dem Aufbau der Seifenmoleküle und ihrer Waschwirkung erkannte, konnte man die Entwicklung moderner, synthetischer Waschmittel in Angriff nehmen. Diese künstlichen Tenside bestehen wie Seifen aus einem langkettigen hydrophoben Kohlenwasserstoffrest und einem hydrophilen Kopf. Dieser wird aber anders als bei den Seifen häufig von einer Sulfat- oder Sulfonatgruppe gebildet. Man ersetzte also die wasserfreundliche Carboxygruppe - auf die man die negativen Eigenschaften der Seife zurückzuführt - durch andere wasserfreundliche Gruppen (Bild 1).
Die Versuche mit solchen Tensiden (z. B. Natriumdodecylbenzolsulfonat, Versuche 4 und 5) zeigen, dass sie keine schwer löslichen Calciumsalze bilden, so dass ihre Waschwirkung auch in hartem Wasser erhalten bleibt. Außerdem sind sie kaum säureempfindlich.