76. Das Methan - einfachster Kohlenwasserstoff
Struktur des Methanmoleküls
Methan ist der einfachste Kohlenwasserstoff, die Summenformel lautet CH4, die C–H-Bindungen weisen in die Ecken eines Tetraeders. Es ist brennbar und verbrennt an der Luft mit bläulicher, nicht rußender Flamme. Es kann explosionsartig mit Sauerstoff oder Chlor reagieren, wozu allerdings eine Initialzündung (Zufuhr von Aktivierungsenergie) oder Katalyse erforderlich ist.
Im Methan bindet ein Kohlenstoffatom über vier Atombindungen vier Wasserstoffatome. Damit erreicht das Kohlenstoffatom die Neonschale und jedes der vier Wasserstoffatome die Heliumschale. Dies kann auf verschiedene Arten dargestellt werden. Beispielsweise werden bei der Elektronenformel die Außenelektronen einzeln symbolisiert, bei der Strichformel (genauer: Valenzstrichformel) werden die Außenelektronen (Valenzelektronen) durch einen Bindungsstrich dargestellt, der dabei zwei Bindungselektronen entspricht (Bild 1). Beide Formeln haben gegenüber der Summenformel den Vorteil, dass seie die Verbindung der einzelnen Atome im Molekül zeigen. Man nennt sie Strukturformeln.
Wenn man sich in Erinnerung ruft, dass sich gleiche Ladungen abstoßen und sich die vier Elektronen des Kohlenstoffatoms daher möglichst weit voneinander entfernen wollen, wird der Tetraeder als räumliche Anordnung des Methanmoleküls verständlich.
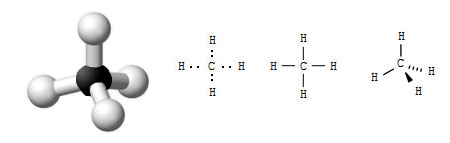
Die Wasserstoffatome im Methanmolekül sitzen also in den Ecken dieses Tetraeders. Der Winkel von Wasserstoffatom zum Kohlenstoffatom ist ein idealer, immer gleicher Tetraederwinkel und beträgt 109,5°. Der räumliche Aufbau des Moleküls wird jedoch oft nicht berücksichtigt und nur vereinfacht dargestellt (Bild 1).
Vorkommen
Methan kommt vielfältig vor und wird auf der Erde ständig neu gebildet, so z.B. bei biologischen und geologischen Prozessen. Auf der Erde werden schätzungsweise jährlich 600 Millionen Tonnen Methan emittiert. Auch auf vielen anderen Planeten gibt es Methanvorkommen.
Die zunehmende Haltung von Rindern, der häufige Nassreisanbau und Emissionen von Deponiegas führen zu einer Verstärkung des Treibhauseffektes. Die archaeellen Methanbildner sind für ie ständige Neubildung von Methan hauptverantwortlich. Ein Hausrind stößt täglich etwa 150–250 l Methan aus, weil im Rindermagen archaeelle Methanbildner an der Zersetzung von Zellulose beteiligt sind.
Methan entsteht im tieferen Untergrund unterhalb der Oberfläche der Erde bei hohen Temperaturen und Drücken und wird meist bei vulkanischen Aktivitäten frei. Es ist Hauptbestandteil des Erdgases (85–98%), das vor allem als Begleiter von Erdöl vorkommt. Auch das in Steinkohlelagern eingeschlossene Grubengas enthält hauptsächlich Methan. Ein großer Teil des Methans wird durch Mikroorganismen gebildet: Beim Faulen organischer Stoffe unter Luftabschluss in Sümpfen oder am Grund stark verschmutzter Gewässer bildet sich Faulgas, ein Gemisch aus Methan und Kohlenstoffdioxid. Faulgas hat mit ca. 27000 kJ · m-3 einen sehr hohen Heizwert. Auch Biogas besteht überwiegend aus Methan (etwa 60 %) und Kohlenstoffdioxid (etwa 35 %), daneben enthält es noch Wasserstoff, Stickstoff und Schwefelwasserstoff.
Eigenschaften
Methan schmilzt bei −182,6 °C und siedet bei −161,7 °C. Aufgrund der unpolaren Eigenschaften ist es in Wasser kaum löslich (in 100 ml Wasser lösen sich bei 20°C nur 3,5 ml), in Ethanol und Diethylether löst es sich jedoch gut.
Das farb- und geruchlose Gas hat eine geringere Dichte als Luft, es steigt also in die höheren Schichten der Erdatmosphäre auf. Dort wirkt es als Treibhausgas, wobei es 20- bis 30-mal wirkungsvoller ist als Kohlenstoffdioxid, allerdings kommt es in viel geringeren Mengen als dieses in der Atmosphäre vor. Es reagiert dort mit Sauerstoff zu Kohlenstoffdioxid und Wasser. Dieser Prozess ist allerdings langsam, die Halbwertszeit wird auf 14 Jahre geschätzt. Methan brennt mit schwach bläulicher Flamme ohne Rußentwicklung:
$ \mathrm {CH_4 + 2 \ O_2 \ \longrightarrow CO_2 + 2 \ H_2O + 883,67 kJ} $
Der Niederschlag mit Kalkwasser beweist, dass Kohlenstoffdioxid entstanden ist. Methan ist leichter als Luft. Hält man eine brennende Kerze in einen mit Methan gefüllten Zylinder, so erlischt sie. Beim Herausziehen entzündet sie sich wieder. Wie der Wasserstoff brennt das Methan an Luft, unterhält aber die Verbrennung nicht. Ein Gemisch aus Methan und Luft explodiert am heftigsten, wenn es ein Mischungsverhältnis wie bei obiger Gleichung aufweist.
Verwendung und Bedeutung
Methan wird vorwiegend als Heizgas zur Wärmeerzeugung und zum Betrieb von Motoren durch Verbrennung genutzt. Neben Methan aus anderen Quellen wird zu diesem Zweck Biogas mit einem Methangehalt von etwa 50 bis >70 % aus Mist, Gülle, Klärschlamm oder organischem Müll gewonnen. Früher wurde Methan durch Pyrolyse von Holz gewonnen (Holzvergasung). Holzgas diente im Zweiten Weltkrieg zum Betrieb von Automobilen.
Methan ist ein wichtiges Ausgangsprodukt für technische Synthesen von Wasserstoff, Methanol, Ethin, Blausäure, Schwefelkohlenstoff und Methylhalogeniden. Es dient als Ausgangspunkt für viele andere organische Verbindungen. Methan zeichnet sich durch hohe Klopffestigkeit aus.