78. Isomerie - Struktur und Eigenschaften
Isomerie
Zwei Verbindungen mit gleicher Summenformel, aber unterschiedlichem Molekülbau nennt man isomere Verbindungen oder kurz Isomere. Sie haben die gleiche Art und Anzahl von Atomen, aber eine unterschiedliche Anordnung ihrer Atome.
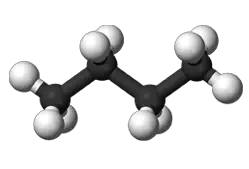
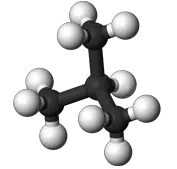
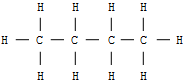
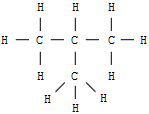
Beim Butan mit der Summenformel C4H10 als erstem in der homologen Reihe der Alkane sind zwei verschiedene Strukturen denkbar, und tatsächlich: Man kennt zwei Butansorten mit gleicher Summenformel, aber verschiedenen Eigenschaften. Diese Erscheinung isomerer Moleküle bezeichnet man als Isomerie. Der Begriff kommt aus dem Griechischen von "isos" für gleich und "meros" für Teil.
Alkane mit einer unverzweigten, gestreckten Kohlenstoffkette heißen n-Alkane (von normal-Alkane). Ihnen gegenüber stehen die isomeren Alkane mit gleicher Anzahl von Atomen, aber mit verzweigter Kohlenstoffkette gegenüber. Sie bezeichnet man als i-Alkane (von iso-Alkane). Eine Molekülformel ab 4 Kohlenstoffatomen lässt sich wegen der Möglichkeit der Isomerie nicht mehr eindeutig einer bestimmten Molekülstruktur zuordnen. In Strukturformeln (die bevorzugte Darstellung in der Organischen Chemie) verzichtet man auf eine räumliche Darstellung und zeichnet den Tetraederwinkel einfach als rechten Winkel. Da Strukturformeln von großen Molekülen recht unübersichtlich sein können, verwendt man oft die anschaulichen Halbstrukturformeln. Hier werden die Kohlenstoffatome mit ihren direkt gebundenen Wasserstoffatomen zu CH2- Gruppen oder CH3- Gruppen zusammengefasst, beispielsweise CH3-CH2-CH2-CH3.
| Name | Summen-formel | Zahl der Isomeren |
|---|---|---|
| Pentan | C5H12 | 3 |
| Hexan | C6H14 | 5 |
| Octan | C8H18 | 18 |
| Decan | C10H22 | 75 |
| Eicosan | C20H42 | 366319 |
| Tetracontan | C40H82 | > 62 Milliarden |
|
|
||
|
|
||
| n - Butan | i - Butan = 2-Methylpropan | ||
| Schmelzpunkt: | -135 °C | Schmelzpunkt: | -145 °C |
| Siedepunkt: | -0,5 °C | Siedepunkt: | -10 °C |

Die Zahl der Isomeren steigt in der homologen Reihe der Alkane mit länger werdender Kohlenstoffkette dramatisch an. Während sich im einfachsten Fall aus der Molekülformel C4H10 zwei mögliche Isomere ableiten lassen, sind es bei C10H22 bereits 75. Beim Tetracontan mit der Summenformel C40H82 ist die Zahl der möglichen Isomere auf mehr als 62 Milliarden angestiegen. Die wenigsten dieser Verbindungen wurden jemals hergestellt oder kommen natürlich vor. Die Isomerie zeigt aber die wichtigste Besonderheit des Kohlenstoffatoms: Es ist in der Lage, verzweigte Ketten zu bilden. Die Isomerie ist somit eine der Erklärungen für die Vielfalt der organischen Verbindungen.
Unterschiedliches Verhalten isomerer Verbindungen
Isomere unterscheiden sich in mindestens einer chemischen bzw. physikalischen Eigenschaft. Beispielsweise zeigt der Vergleich von Butan und Isobutan (2-Methyl-Propan), welche beide die Summenformel C4H10 haben, dass beide abweichende Schmelz- und Siedetemperaturen haben. Die Schmelztemperatur von Butan liegt bei -135° C, die von Isobutan bei -165° C.
| Name | Schmelzpunkt in °C | Siedepunkt in °C |
|---|---|---|
| n-Hexan | -94,0 | 68,7 |
| 2-Methylpentan | -153,7 | 60,3 |
| 2,2-Dimethylbutan | -98,2 | 49,7 |
| 2,3-Dimethylbutan | -128,8 | 58,0 |
| 3-Methylpentan | -118,0 | 63,3 |
Bei Molekülen mit verzweigten Ketten befinden sich mehr Atome im Inneren des Moleküls, wodurch sich die Oberfläche verkleinert und damit weniger Kerne und Elektronen miteinander wechselwirken können. Bei verzweigten Kohlenwasserstoffen wirken die Van-der-Waals-Kräfte also geringer als bei verzweigten Kohlenwasserstoffen, was sich sich in tieferen Schmelz- und Siedepunkten ausdrückt.
$ \mathrm { H –{ \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} –{ \overset {\Large {CH_3}} {\overset {|} { \underset {\Large {CH_3}} {\underset {|}{C}}}}} –{ \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} –{ \overset {\Large {CH_3}} {\overset {|} { \underset {\Large {CH_3}} {\underset {|}{C}}}}} –{ \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} –H }$
Benennung von Isomeren
Die Wissenschaftler mussten angesichts der Vielzahl möglicher organischer Verbindungen ein einheitliches und verständliches System bei der Benennung isomerer Verbindungen entwickeln. Folgendes muß man beachten:
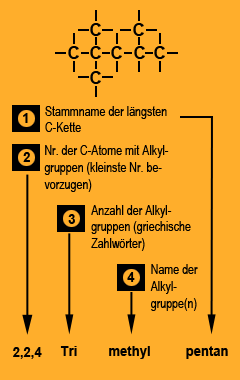
- Zunächst sucht man die längste fortlaufende Kohlenstoffkette. Aus der Zahl der Kohlenstoffatome dieser Kette folgt der Stammname des Alkans. Der Stammname leitet sich also von der längsten Kohlenstoffkette ab.
- Die Seitenketten werden ebenfalls nach der Zahl ihrer Kohlenstoffatome benannt und dem Stammnamen vorangestellt. Diese Alkylgruppen leiten sich durch die formale Abspaltung eines Wasserstoffatoms von den Alkanmolekülen ab. Sie erhalten anstelle der Endung -an die Endung -yl (Beispielsweise Methyl für –CH3, Ethyl für –C2H5, Propyl für –C3H7 usw. ) Treten im Molekül verschiedene Seitenketten auf, so werden diese alphabetisch geordnet.
- Wenn gleiche Seitenketten mehrfach auftreten, dann verwendet man als Vorsilbe das entsprechende greichische Zahlwort (di-, tri-, tetra-, penta-). Sie werden bei der alphabetischen Ordnung der Seitenketten nicht beachtet.
- Zur Kennzeichnung der Verknüpfungsstellen zwischen Haupt- und Seitenketten nummeriert man die Kohlenstoffatome der Hauptkette fortlaufend durch. Dabei ist zu beachten, dass die Verknüpfungsstellen kleinstmögliche Zahlen erhalten. Wenn von einem Kohlenstoffatom aus der Hauptkette zwei Seitenketten abgehen, so taucht die Nummer dieses Kohlenstoffatoms auch zweimal im Isomerennamen auf.