Sulfonamide
amids. R ist ein Organylrest oder ein Wasserstoffatom.
Sulfonamide sind eine Gruppe synthetischer chemischer Verbindungen, die zunächst als Chemotherapeutika im Bereich der Antibiotika eingesetzt wurden. Neuere Generationen von Sulfonamidarzneistoffen dienen auch als Antidiabetika („Sulfonylharnstoffe“) und Diuretika („Thiaziddiuretika“). Strukturell sind Sulfonamide Amide von Sulfonsäuren, die durch die Gruppe –SO2NHR– charakterisiert sind.
Ihre Wirkung als antimikrobielle Agenzien zur Behandlung von Infektionskrankheiten beruht darauf, dass sie als Antimetabolite der p-Aminobenzoesäure (PABA) dasjenige Enzym des Stoffwechselweges der Folsäure-Synthese kompetitiv inhibieren, welches die Dihydropteroinsäure-Bildung katalysiert. Eukaryotische (und damit auch menschliche) Zellen werden hiervon nicht beeinträchtigt, da diese Folsäure nicht selbst erzeugen. Die Wirksamkeit beruht dabei auch auf der strukturellen Ähnlichkeit der Sulfonamide mit Carbonsäureamiden, wobei deren Carbonylgruppe durch eine Sulfonylgruppe ersetzt ist; sie sind also Analoga von Amiden. Typische Vertreter sind Sulfamethoxazol, das länger wirksame Sulfadoxin, das Sulfacarbamid mit kürzerer Wirkdauer oder Sulfasalazin, das im Darm nicht aufgenommen wird.
Darstellung
Für die Herstellung der Sulfonamide sind unterschiedliche Synthesen entwickelt worden. Entscheidend für die gewählte Art der Synthese ist die Verfügbarkeit der Ausgangschemikalien und ein einfacher und problemloser Verlauf der einzelnen Zwischenschritte. Nachfolgend sind als Beispiel für die Darstellung von Sulfonamiden zwei mögliche Synthesen für Sulfapyridin dargestellt.
- Kondensation von p-Acetamino-benzol-sulfochlorid mit einem Amin und anschließender Hydrolyse der Acetylgruppe:[1]
oder als zweite Möglichkeit:
- Kondensation von p-Nitrobenzolsulfonsäurechlorid mit einem Amin und der anschließenden Reduktion der Nitrogruppe:[2]
Geschichte
Entwicklung synthetischer Antibiotika
Mit der wissenschaftlichen Erforschung und der Synthese von organischen Verbindungen im 19. Jahrhundert begann auch die Suche nach Verbindungen mit antibakteriellen Eigenschaften. Paul Ehrlich gehörte zu den ersten Chemikern, die systematisch chemische Verbindungen auf ihre Wirkung auf Bakterien hin untersuchten. Ehrlichs Arbeitsschwerpunkt lag dabei auf Azofarbstoffen und ähnlichen Verbindungen. Nach Untersuchungen mit dem Azofarbstoff Trypanrot und der arsenhaltigen Verbindung Atoxyl vermutete er, dass Strukturen mit Azogruppen (-N=N-) wie auch arsenorganische Verbindungen (-As=As-) besonders geeignet seien.[3] In seinem Labor wurden deshalb viele neue arsenhaltige Verbindungen synthetisiert und überprüft.
Für das 1909 in seinem Labor entwickelte Salvarsan konnte Ehrlich zusammen mit dem japanischen Bakteriologen Sahachiro Hata in der Folgezeit, bis 1910,[4] die antibakterielle Wirkung gegenüber Spirochäten und Trypanosomen nachweisen. Mit Salvarsan war erstmals eine ursächliche Behandlung und Heilung der Syphilis bei vertretbaren toxischen Nebenwirkungen möglich. Das in Deutschland entwickelte Salvarsan wurde patentiert und als einer der ersten vollsynthetischen Arzneistoffe bekannt. Das Patent wurde im 1. Weltkrieg von den USA übernommen, und die Verbindung unter dem Namen Arsphenamin weiter verwendet.[5]
Bereits 1908[1] hatte Paul Gelmo mit Sulfanilamid den ersten Vertreter aus der Stoffgruppe der Sulfonamide entwickelt. Heinrich Hörlein, der Sulfonamide mit Azostruktur (-N=N-) bereits als Textilfarbstoffe verwendet hatte,[6] war die treibende Kraft hinter einem Forschungsprogramm der I. G. Farben zur systematischen Entwicklung von antibakteriell wirksamen Verbindungen aus der Gruppe der Farbstoffe aus der Steinkohlenteer-Chemie nach dem Vorbild von Ehrlichs Salvarsan. 1932 synthetisierten Fritz Mietzsch und Joseph Klarer innerhalb dieses Programms ein Sulfonamid, das unter dem Namen Prontosil bekannt wurde. Dessen antibakterielle Wirkung wurde von Gerhard Domagk entdeckt, der für die I.G. Farben im Bayer-Stammwerk in Wuppertal (Elberfeld) an Azofarbstoffen forschte. Außerhalb des lebenden Organismus (in vitro) zeigte sich Prontosil weitgehend unwirksam, wirksam war es nur in vivo. Insbesondere der Nachweis der Wirkung im Tiermodell war das Verdienst von Domagk.
Im Februar 1935[7] veröffentlichte Domagk seine Untersuchungen und über die medizinische Wirksamkeit von Prontosil. 1939 wurde Domagk für sein Werk der Nobelpreis verliehen, den er jedoch wegen der zu diesem Zeitpunkt geltenden Gesetze im 3. Reich nicht annehmen durfte.[8]
Der Wirkungsmechanismus von Prontosil wurde 1935[1] von Jacques Tréfouël, Thérèse Tréfouël, Federico Nitti und Daniel Bovet im Laboratorium von Ernest Fourneau aufgeklärt:[9] Prontosil wird erst im Organismus zum wirksamen Bestandteil Sulfanilamid verstoffwechselt, was seine Wirkungslosigkeit in vitro erklärt.
Mit den Sulfonamiden waren die ersten Breitspektrumantibiotika verfügbar, die in der Medizin mit Erfolg verwendet wurden. Erst später im 2. Weltkrieg ab 1940[10] wurde von Florey und Dunn das Penicillin ebenfalls in die medizinische Therapie eingeführt.[Anm. 1]
Bis Ende der 1930er Jahre wurden über 1000[1] sulfonamidische Verbindungen synthetisiert. Allerdings sind davon nur wenige pharmakologisch wirksam. Alle bisher geprüften kernsubstituierten Derivate des Sulfanilamids sind völlig unwirksam.[1] Besonders wirksam sind hingegen Verbindungen, die die Struktur
enthalten.[1]
Verbreitete Anwendung fanden die Sulfonamide (in Klammern Angabe des Einführungsjahres) Sulfapyridin (1938), Sulfathiazol (1940), Sulfaguanidin (1940), Sulfadiazin (1941), Phthalylsulfathiazol (1942) sowie Mono- und Dimethyl-Derivate des Sulfathiazins (1943).[2]
Das erste Medikament mit einem Sulfonamid-Wirkstoff war Prontosil. Sieht man von Prontosil ab, so sind die meisten Sulfonamide sowohl in vitro als auch in vivo wirksam.[11] Der antibakterielle Wirkmechanismus der Sulfonamide als Antimetabolite wurde 1940 von Donald D. Woods und Paul Fildes aufgeklärt. Penicillin und die diversen weiteren Verbindungen dieses Typs haben inzwischen weitgehend die Sulfonamide bei der medizinischen Verwendung abgelöst, da sie bei geringerer Dosierung sicherer wirken.[12]
Zu den wenigen im Bereich der Medizin für Menschen auch in heutiger Zeit[13] noch verwendeten Sulfonamiden gehören die Verbindungen Sulfamethoxazol, Silbersulfadiazin und Sulfamerazin. In der Tiermedizin, besonders für die Behandlung von Erkrankungen durch Parasitenbefall, werden dagegen noch vielfach Kombinationspräparate mit Sulfonamiden verwendet.
Mit den Sulfonamiden strukturell verwandte Substanzen sind die Sulfonylharnstoffe, die als orale Antidiabetika verwendet werden, und die Thiaziddiuretika.
Versuche zur Zeit des Nationalsozialismus
Zur Zeit des Nationalsozialismus fanden medizinische Experimente an KZ-Häftlingen in den Lagern KZ Ravensbrück und KZ Dachau statt. Unter der Aufsicht von Himmlers Leibarzt Karl Gebhardt war die Nazi-Ikone Reinhard Heydrich an Sepsis verstorben, Hitlers Leibarzt Morell hatte kritisiert, Heydrich hätte möglicherweise überlebt, hätte man das Sulfonamid Ultraseptyl eingesetzt. Bei Heydrich wurden andere Sulfonamide verabreicht, Gebhardt kam in Bedrängnis. KZ-Häftlingen wurden absichtlich Verletzungen beigefügt und Wunden infiziert, um eine Sepsis zu erreichen und die Wirkweise verschiedener Sulfonamide testen zu können.[14]
Tabelle Sulfonamide
Die nachfolgende Tabelle zeigt einen Überblick über die ersten einfacheren Verbindungen und die noch heute aktuellen Sulfonamide. Darüber hinaus werden aber auch noch weitere hier nicht aufgelistete Vertreter dieser Wirkstoffklasse in der Medizin verwendet. Als Antibiotika werden überwiegend Gemische aus 2 oder mehreren Sulfonamiden oder auch anderen Wirksubstanzen eingesetzt. Von fast allen einzelnen Verbindungen sind für die Namen sehr viele Synonyme - zum Teil weit über 20 - gebräuchlich.
| Struktur | INN-Name | CAS PubChem |
Summenformel | IUPAC-Name | Verwendung[15] |
|---|---|---|---|---|---|
| Sulfanilamid | 63-74-1 5333 |
C6H8N2O2S | 4-Aminobenzol-sulfonamid | Grundbaustein der Sulfonamide | |
| Sulfathioharnstoff | 515-49-1 3000579 |
C7H9N3O2S2 | 4-Aminophenyl-sulfonylthioharnstoff | kaum noch verwendet | |
| Sulfacarbamid | 547-44-4 11033 |
C7H9N3O3S2 | 1-(4-Aminobenzensulfonyl)harnstoff | in der Humanmedizin | |
| Mafenid | 138-39-6 3998 |
C7H10N2O2S | 4-(Aminomethyl)benzolsulfonamid | in der Tiermedizin und Humanmedizin (Verbrennungen) | |
| Sulfaguanidin | 57-67-0 5324 |
C7H10N4O2S | 4-Amino-N-(diaminomethylen)benzolsulfonamid | in der Tiermedizin (selten angewendet) | |
| Sulfacetamid | 144-80-9 5320 |
C8H10N2O3S | N-(p-aminophenyl-sulfonyl)acetamid | in der Humanmedizin (Augen) | |
| Sulfathiazol | 72-14-0 5340 |
C9H9N3O2S2 | 4-Amino-N-(1,3-thiazol-2yl)benzolsulfonamid | in der Tiermedizin | |
| Sulfamethizol | 144-82-1 5328 |
C9H10N4O2S2 | 4-Amino-N-(5-methyl-1,3,4-thiadiazol-2yl)benzolsulfonamid | in der Tiermedizin | |
| Sulfametrol | 32909-92-5 64939 |
C9H10N4O3S2 | 4-Amino-N-(4-methoxy-1,2,5-thiadiazol-3yl)benzolsulfonamid | in Humanmedizin[16] | |
| Sulfamethylthiazol | 515-59-3 5328 |
C10H11N3O2S2 | 4-Amino-N-(4-methyl-1,3-Thiazol-2yl)benzolsulfonamid | in der Humanmedizin | |
| Sulfachlorpyridazin | 80-32-0 6634 |
C10H9ClN4O2S | 4-Amino-N-(6-chloro-3-pyridazinyl)benzolsulfonamid | in der Tiermedizin | |
| Sulfachlorpyrazin | 1672-91-9 164867 |
C10H9ClN4O2S | 4-Amino-N-(6-chloropyrazin-2yl)benzolsulfonamid | in der Tiermedizin für Geflügel | |

|
Sulfadiazin | 68-35-9 5215 |
C10H10N4O2S | 4-Amino-N-(2-pyrimidinyl)benzolsulfonamid | in der Tiermedizin |
| Sulfamethoxazol | 723-46-6 5329 |
C10H11N3O3S | 4-Amino-N-(5-methyl-3-isoxazolyl)benzolsulfonamid | in der Human- und Tiermedizin | |
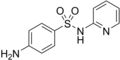
|
Sulfapyridin | 144-83-2 5336 |
C11H11N3O2S | 4-Amino-N-pyridin-2-yl-benzolsulfonamid | in der Humanmedizin (Haut) |
| Sulfamerazin | 127-79-7 5325 |
C11H12N4O2S | 4-Amino-N-(4-methyl-2-pyrinidinyl)benzolsulfonamid | in der Tiermedizin[17] | |
| Sulfaperin | 599-88-2 68933 |
C11H12N4O2S | 4-Amino-N-(5-methylpyrimidinyl)benzolsulfonamid | nicht mehr angewendet | |
| Sulfamethoxypyridazin | 80-35-3 5330 |
C11H12N4O3S | 4-Amino-N-(6-methoxypyridazin-3yl)benzolsulfonamid | in der Tiermedizin | |
| Sulfamethoxydiazin | 651-06-9 5326 |
C11H12N4O3S | 4-Amino-N-(5-methoxy-2-pyrimidinyl)benzolsulfonamid | in der Humanmedizin | |
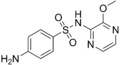
|
Sulfalen | 152-47-6 9047 |
C11H12N4O3S | 4-Amino-N-(3-methoxy-2-pyrazinyl)benzolsulfonamid | in der Tier- und Humanmedizin |
| Sulfamoxol | 729-99-7 12894 |
C11H13N3O3S | 4-Amino-N-(4,5-dimethyl-1,3-oxazol-2yl)benzolsulfonamid | in der Humanmedizin[18] | |
| Sulfafurazol | 127-69-5 5344 |
C11H13N3O3S | 4-Amino-N-(3,4-dimethyl-5-isoaxazolyl)benzolsulfonamid | in der Humanmedizin[19] | |
| Sulfadicramid | 115-68-4 8281 |
C11H14N2O3S | N-(3,3-dimethylacroyl)sulfanilamid | in der Humanmedizin (kaum noch verwendet) | |
| Sulfadimidin | 57-68-1 5327 |
C12H14N4O2S | 4-Amino-N-(4,6-dimethyl-2-pyrimidinyl)benzolsulfonamid | in der Tiermedizin | |
| Sulfasomidin | 515-64-0 5343 |
C12H14N4O2S | 4-Amino-N-(2,6-dimethyl-2-pyrimidin-4yl)benzolsulfonamid | in der Humanmedizin[20] | |
| Sulfametomidin | 3772-76-7 19596 |
C12H14N4O3S | 4-Amino-N-(6-methoxy-2-methylpyrimidin-4yl)benzolsulfonamid | in der Humanmedizin | |
| Sulfadimethoxin | 122-11-2 5323 |
C12H14N4O4S | 4-Amino-N-(2,6-dimethoxy-4-pyrimidinyl)benzolsulfonamid | in der Tiermedizin | |
| Sulfadoxin | 2447-57-6 17134 |
C12H14N4O4S | 4-Amino-N-(5,6-dimethoxy-4-pyrimidinyl)benzolsulfonamid | in der Tiermedizin | |
| Sulfaphenazol | 526-08-9 5335 |
C15H14N4O2S | 4-Amino-N-(2-phenylpyrazol-3yl)benzolsulfonamid | in der Tiermedizin | |
| Sulfasalazin | 599-79-1 5359476 |
C18H14N4O5S | 2-Hydroxy-5-((2-((pyridinyl)sulfonyl)phenyl)azo)benzoesäure | in der Human- und Tiermedizin |
Eigenschaften
Sulfonamide wirken bakteriostatisch. Werden sie einzeln eingesetzt, bilden sich schnell Resistenzen. Daher kombiniert man sie bevorzugt mit Dihydrofolsäurereduktase-Hemmern wie Trimethoprim (Cotrimoxazol s.u.). Sie sind relativ hydrophil, können als Tablette gegeben werden und werden mit unterschiedlichen Halbwertszeiten überwiegend über die Nieren ausgeschieden. Den Prozess der Sezernierung in den Nierentubuli teilen sie mit einigen anderen Säuren, die sich dann gegenseitig in ihrer Ausscheidung behindern: Harnsäure, Urikosurika und Urikostatika, Acetylsalicylsäure, Thiaziddiuretika, Penicillin und Makrolide. Der Ausscheidungsweg hat außerdem zur Folge, dass sie sich im harnableitenden System anreichern, was auch ihren wesentlichen Anwendungsbereich darstellt.
Anwendung
Sulfonamide wirken gegen Darmbakterien, zum Beispiel Escherichia coli, Pseudomonas, Salmonella, Shigella. Sie wirken außerdem gegen Staphylococcus, Streptococcus, Neisseria, Pneumocystis jirovecii, Toxoplasma gondii, Neospora caninum und Plasmodien. Sie werden hauptsächlich als Cotrimoxazol gegen unkomplizierte Harnwegsinfektionen eingesetzt und gegen Pneumonie durch Pneumocystis jirovecii (früher: P. carinii), hier als einziges Medikament. Ferner werden sie in diversen Kombinationen gegen therapiebedürftige Toxoplasmose oder Malaria eingesetzt. Gegen Bacteroides, Enterococcus [21], Mykoplasmen, Pilze, Pseudomonas aeruginosa, die meisten Protozoen, Rickettsien und Viren sind Sulfonamide allerdings wirkungslos.[22]
In der Veterinärmedizin sind Sulfonamide gängige Antibiotika, die bei Atemwegs-, Magen-Darm- und Harnwegserkrankungen eingesetzt werden. Des Weiteren sind sie oft Mittel der Wahl bei der Behandlung von Nagetieren, da diese im Allgemeinen eine breite Unverträglichkeit auf Antibiotika (insbesondere Penicillin) aufweisen. Im Geflügelbereich waren Sulfonamide über lange Zeit das Mittel zur Bekämpfung von Kokzidien.
Sulfonamide werden meist in Kombination mit Diaminopyrimidinen eingesetzt. Eine fixe Kombination der Stoffe Sulfamethoxazol plus Trimethoprim im Verhältnis 5 zu 1 heißt Cotrimoxazol. Die Kombination soll der Entstehung von Antibiotikaresistenzen vorbeugen, außerdem potenziert sich die Wirkstärke von Antibiotika, die den gleichen Stoffwechselweg an unterschiedlicher Stelle blockieren. Für die Monotherapie wird in Deutschland nur noch Sulfadiazin eingesetzt zur Behandlung der akuten und rezidivierenden Toxoplasmose.
Wechselwirkungen
Bei gleichzeitiger Verabreichung von Lokalanästhetika aus der Gruppe der para-Aminobenzoesäureester (zum Beispiel Procain oder Tetracain) kommt es zu einem Antagonismus, da diese die Wirkung von Sulfonamiden aufheben. Weiterhin kommt es zu unerwünschten Wechselwirkungen mit Hexamethylentetramin (Methenamin) und zum Teil auch mit Phenylbutazon.
Nebenwirkungen
Sulfonamide sind nicht für die Schwangerschaft zugelassen, vor allem nicht um den Geburtstermin herum, da sie beim Neugeborenen eine gefährliche Hyperbilirubinämie verursachen können. Zum anderen können Allergien bestehen, vor allem auf der Haut - hier können Sulfonamide auch eine starke Phototoxizität auslösen. Selten kommen Blutbildveränderungen oder hepatische Cholestase vor, wie bei den Sulfonylharnstoffen. Bei Patienten mit erblichen Methämoglobinämien „führt eine Medikation mit Sulfonamiden zu schweren hämolytischen Krisen.“ [23]
Außerdem wird die Kammerwasserbildung gehemmt, da Sulfonamide die Wirkung der Carboanhydrase hemmen. Dies führt zu einer effektiven Senkung des Augendrucks. Augentropfen mit modifizierten Sulfonamiden werden deswegen heute als Mittel der ersten Wahl bei der Behandlung des Glaukoms verwendet.
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 L. F. Fieser, M. Fieser: In: Lehrbuch der organischen Chemie, 3.Auflage. Verlag Chemie, Weinheim a. d. Bergstraße 1957, S. 1191.
- ↑ 2,0 2,1 L. F. Fieser, M. Fieser In: Lehrbuch der organischen Chemie. 3.Auflage. Verlag Chemie, Weinheim a. d. Bergstraße 1957, S. 1193.
- ↑ L. F. Fieser, M. Fieser In: Lehrbuch der organischen Chemie. 3.Auflage. Verlag Chemie, Weinheim a. d. Bergstraße 1957, S. 1182.
- ↑ Brockhaus der Naturwissenschaften und der Technik. 4. Auflage. Brockhaus, Wiesbaden 1958, S. 480.
- ↑ L. F. Fieser, M. Fieser: In: Lehrbuch der organischen Chemie. 3. Auflage. Verlag Chemie, Weinheim a. d. Bergstraße 1957, S. 1183.
- ↑ Brockhaus der Naturwissenschaften und der Technik. 4. Auflage. Brockhaus, Wiesbaden 1958, S. 553.
- ↑ Domagk Beitrag zur Chemotherapie der bakteriellen Infektionen, Deutsch. Med. Wochenschrift, Band 61, 15. Februar 1935, S. 250-253, Domagk Chemotherapie der bakteriellen Infektionen, Angewandte Chemie, Band 46, 1935, S. 657-667
- ↑ Zur Geschichte der Sulfonamide auch John Lesch The miracle drugs, Oxford University Press 2006
- ↑ J. und Th. Tréfouël, F. Nitti und D. Bovet, « Activité du p.aminophénylsulfamide sur l’infection streptococcique expérimentale de la souris et du lapin », C. R. Soc. Biol., 120, 23 November 1935, S. 756.
- ↑ Brockhaus der Naturwissenschaften und der Technik; 4. Auflage. Brockhaus, Wiesbaden 1958, S. 411.
- ↑ L. F. Fieser, M. Fieser: Lehrbuch der organischen Chemie. 3.Auflage. Verlag Chemie, Weinheim a. d. Bergstraße 1957, S. 1194
- ↑ Herder Lexikon Chemie. Lizenzausgabe für Bertelsmann Club, Gütersloh, Buch-Nr. 03838 0, S. 232.
- ↑ http://www.flexikon.doccheck.com/Sulfonamid-Antibiotika unter Punkt 3.
- ↑ Zámečník: Das war Dachau. Stiftung Comité International de Dachau, Luxemburg 2002, S. 285 ff.
- ↑ alle Angaben, sofern nichts anderes angegeben, aus der Datenbank CliniPharm
- ↑ Frank A. Plumer et.al.; In:N Engl. J. Med.; 1983, 309, S. 67-71.
- ↑ Datenblatt Sulfamerazin bei Vetpharm, abgerufen am 23. Juni 2012.
- ↑ http://jcp.sagepub.com/cgi/content/abstract/1/6/279.
- ↑ http://www.nlm.nih.gov/medlineplus/druginfo/meds/a601049.html.
- ↑ Anderson EA, Knouff EG, Bower AG; In:Calif. Med. 1956 May; 84 (5):329-30.
- ↑ Junyi Xu & Claudia Gallert & Josef Winter, Appl Microbiol Biotechnol (2007) 74:493–500.
- ↑ Thieme Chemistry (Hrsg.): Eintrag zu Sulfonamide im Römpp Online. Version 3.29. Georg Thieme Verlag, Stuttgart 2012, abgerufen am 25. Juni 2011.
- ↑ M. Buchta: Molekulare Grundlagen der Humangenetik. In: M. Buchta, D. W. Höper, A. Sönnichsen: Das Hammerexamen. Repetitorium für den 2. Abschnitt der Ärztlichen Prüfung. 1. Auflage. Elsevier, München 2006, S. 1426.
Anmerkungen
- ↑ L. F. Fieser, M. Fieser: In: Lehrbuch der organischen Chemie. 3.Auflage. Verlag Chemie, Weinheim a. d. Bergstraße 1957, S. 1196. wird nicht Dunn, sondern Chain als 2. Forscher angeführt.
| Bitte den Hinweis zu Gesundheitsthemen beachten! |