42. Säuren - Protonendonatoren
Die Protolyse von Säuren
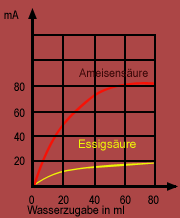
Nach Versuch 1 ergibt die Prüfung der Leitfähigkeit, dass es in wasserfreier Ameisensäure keine Ladungsträger gibt. Vermischt man nun die Ameisensäure mit Wasser, dann entstehen Ionen. Es kommt wie bei der Reaktion von HCl mit H2O zur Protolyse - freibewegliche elektrische Teilchen sind entstanden.
Allerdings kann die Protolyse der Ameisensäure nicht einfach auf die Verdünnung zurückgeführt werden, denn dann müßte auch eine Lösung in Aceton, Tetrachlorkohlenstoff usw. zur Leitung des elektrischen Stroms führen. Das aber ist nicht der Fall.
Ein umfassender Säurebegriff
Säuren sind im engeren Sinne alle chemischen Verbindungen, die in der Lage sind, Protonen (H+) an einen Reaktionspartner zu übertragen – sie können als Protonendonator fungieren. In wässriger Lösung ist der Reaktionspartner im Wesentlichen Wasser. Es bilden sich Oxonium-Ionen (H3O+), der pH-Wert der Lösung wird damit gesenkt. Säuren reagieren mit sogenannten Basen unter Bildung von Wasser und Salzen. Eine Base ist somit das Gegenstück zu einer Säure und vermag diese zu neutralisieren.
Säuren sind also Verbindungen, die Wasserstoff-Ionen (Protonen) abgeben, die in Wasser hydratisiert werden. Stellt man sich HR als ein Säuremolekül vor, dann läßt sich der chemische Vorgang so beschreiben:
$ \mathrm { HR \quad\quad\quad\quad \xrightarrow{H_{2}O} \quad\quad\quad\quad H^{+}_{(aq)} \quad\quad + \quad\quad R^{-}_{(aq) } }$
Säure$ \qquad \ \ \ \ \ \mathrm {\longrightarrow} \qquad $ hydratisiertes Proton $ \ \mathrm { + } \ $ Säurerest-Ion

In unseren Fällen war immer das Wassermolekül der Protonenempfänger - das muß nicht allgemein so sein. Im weiteren Sinn beschreiben verschiedene Säure-Base-Konzepte wesentlich breitere Paletten von chemischen Reaktionen, die weit über die oben erwähnten Reaktionen hinausreichen können. Grundsätzlich gilt: Säuren sind Protonendonatoren. Das nach Abgabe des Protons entstandene Ion ist das Säurerestion.
Säuren und Indikatoren
Die hydratisierten Protonen der Salzsäure wurden in Kapitel 41 mit dem Farbstoff Lackmus nachgewiesen. Auch andere Farbstoffe, die mit Säuren reagieren und dabei eine charakteristische Farbe annehmen (Versuch 3), können zum Nachweis von Säuren benutzt werden. Solche Farbstoffe nennt man Indikatoren (genauer Säureindikatoren).
Die Reaktion von Säuren mit bestimmten Pflanzenfarbstoffen war schon den Forschern früherer Jahrhunderte aufgefallen. Sie definierten »Säuren als Verbindungen, die Lackmus u. a. Pflanzenfarbstoffe charakteristisch färben«. In der Alchemie galt Säure als ein Urstoff. Die sauren Eigenschaften basierten auf einer einzigen Ursäure, die in verschiedenen Substanzen zur Wirkung kam. Säuren lassen Kalk bzw. Carbonate aufschäumen, haben eine ätzende Wirkung und einen sauren Geschmack. Bis Ende des 13. Jh. waren wohl neben Essig und anderen Pflanzensäften keine weiteren Säuren bekannt.
Protolyse bekannter Säuren
$\mathrm {\quad \scriptsize {\mathsf {Säure}} \quad \xrightarrow {\normalsize {\mathsf {Wasser}}} \quad {\mathsf {hydratisiertes \ Proton}} \ + \ {\mathsf {hydratisiertes \ Säurerestion}}}$
$\mathrm {\underbrace {HNO_3}_{\mathsf {Salpetersäure}} \ \xrightarrow{H_2O} \quad \underbrace {H^+_{(aq)}}_{\mathsf {Proton}} \quad + \quad \underbrace {NO^-_{3 \ (aq)}}_{\mathsf {Nitration}}}$
$\mathrm {\underbrace {H_2CO_3}_{\mathsf {Kohlensäure}} \ \xrightarrow{H_2O} \quad \underbrace {2H^+_{(aq)}}_{\mathsf {Proton}} \quad + \quad \underbrace {CO^{2-}_{3 \ (aq)}}_{Carbonation}}$
$\mathrm {\underbrace {H_2SO_4}_{\mathsf {Schwefelsäure}} \ \xrightarrow{H_2O} \quad \underbrace {2H^+_{(aq)}}_{\mathsf {Proton}} \quad + \quad \underbrace {SO^{2-}_{4 \ (aq)}}_{\mathsf {Sulfation}}}$