4. Das Teilchenmodell und die Zustandsformen der Materie
Der Stoffbau in der Modellvorstellung
Die Chemie begnügt sich nicht mit der möglichst genauen Beschreibung von Stoffen. Vielmehr versuchen Chemikerinnen und Chemiker, die im Experiment ermittelten Eigenschaften und Vorgänge zu erklären. Die Chemie hat dazu einfache Modelle oder Modellvorstellungen entwickelt, wobei jedes Modell und jede Modellvorstellung nur innerhalb eines bestimmten Bereichs Gültigkeit hat. Nach Demokrit, der im vierten Jahrhundert v.Chr. lebte, bestehen alle Stoffe aus kleinen, unteilbaren Teilchen, die er als Atome bezeichnete.

Dem Engländer John Dalton (1766 - 1844) gelang ein wichtiger Schritt bei der Aufklärung des Aufbaus von Stoffen. Dass Stoffe in den Aggregatzuständen fest, flüssig und gasförmig auftreten können, erklärte er damit, dass alle Stoffe aus unzähligen, äußerst winzigen Teilchen bestehen, die miteinander durch stärkere oder schwächere Anziehungskräfte verbunden sind. Nach seiner Modellvorstellung glaubte Dalton, dass bei Feststoffen die Teilchen stark verbunden sind, bei Flüssigkeiten weniger stark und bei Gasen nicht mehr.
Wie man sich den atomaren Aufbau von Stoffen leichter vorstellen kann, erläutern die Beschreibungen der Versuche 1 und 2 sowie Bild 1 und 2. Gibt man in einen Meßzylinder 100 ml Wasser und schüttet weitere 100 ml dazu, so befinden sich jetzt im Meßzylinder zweifellos 200 ml Wasser. Beim Vermischen von Wasser und Alkohol beobachtet man dagegen eine Volumenverminderung, was im ersten Moment überraschend erscheint. Mit den beiden folgenden Modellversuchen kann man diese Beobachtung aber erklären.
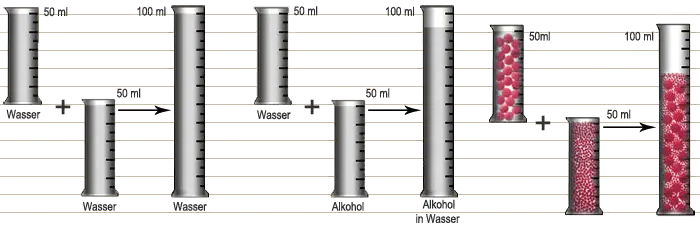
Rechts: Gleiche Mengen Alkohol und Wasser werden vermischt.
Auch Versuch 2 erscheint im ersten Moment überraschend, denn auch beim Vermischen der großen und kleinen Kugeln gibt es eine Volumenverminderung. Man konnte beobachten, wie die kleinen Kugeln die Zwischenräume zwischen den großen Kugeln ausfüllten. Wenn man die Meßzylinder aus einiger Entfernung betrachtet, so haben sie scheinbar einen einheitlichen Inhalt und die einzelnen Kugeln können nicht mehr erkannt werden. Daltons Modell vom Stoffaufbau erklärt diese Beobachtung. Die kleinen Wasserteilchen haben sich mit den großen Teilchen des Alkohols vermischt, ähnlich wie die unterschiedlich großen Kugeln im Versuch.
Die Wärmebewegung der Teilchen
Der englische Botaniker Robert Brown (1773-1858) machte im Jahre 1827 bei der Betrachtung von Blütenstaub unter dem Mikroskop eine interessante Entdeckung. Zur Untersuchung des Blütenstaubs gab er in einen Tropfen Wasser Blütenstaubkörnchen, die sich unregelmäßig bewegten (Bild 4).
Diese Bewegung beobachtet man unter dem Mikroskop auch bei vielen anderen Dingen und nennt sie nach Brown die Brownsche Bewegung der Teilchen. Die unsichtbaren Teilchen einer Flüssigkeit sind in ständiger Bewegung und stoßen häufig miteinander und den viel größeren Blütenstaubkörnchen zusammen, die dadurch in eine Zitterbewegung versetzt werden. Wenn man den Wassertropfen mit dem Blütenstaub erwärmt, wird diese Zitterbewegung immer heftiger, während sie beim Abkühlen abnimmt.
Die Eigenbewegung der Teilchen bezeichnet man als Wärmebewegung. Auch die Teilchen eines Festkörpers bewegen sich um eine bestimmte Ruhelage.
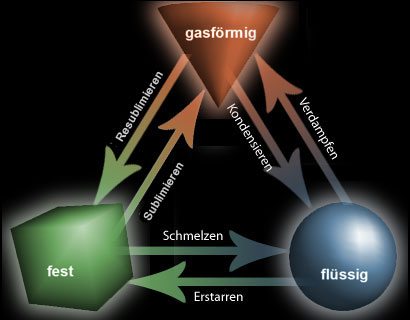
Zustandsänderungen der Materie
Schmelzen
Wenn ein Festsoff erhitzt wird, bekommen seine Teilchen mehr Energie und bewegen daher mehr. Dies führt dazu, dass sich der Feststoff ausdehnt. Am Schmelzpunkt schwingen die Teilchen so stark, dass sie von ihren gegenwärtigen Positionen ausbrechen. Der Feststoff wird flüssig.
Sieden
Wenn eine Flüssigkeit erhitzt wird, bekommen ihre Teilchen mehr Energie und bewegen sich schneller. Sie stoßen öfter aneinander und springen dadurch weiter auseinander. Dies führt dazu, dass sich die Flüssigkeit ausdehnt. Am Siedepunkt erhalten die Teilchen genügend Energie, um die Kräfte zu überwinden, die sie bis dahin zusammengehalten haben. Sie brechen aus der Flüssigkeit aus und bilden ein Gas.
Verdampfen
Einige Teilchen in einer Flüssigkeit haben mehr Energie als andere. Selbst wenn eine Flüssigkeit nicht siedet, haben einige Teilchen genug Energie, um zu entkommen und ein Gas zu bilden. Dies bezeichnet man als Verdunstung. Dies ist der Grund, warum Pfützen in der Sonne austrocknen, auch wenn sie nicht sieden.
Kondensieren und Erstarren
Wenn ein Gas gekühlt wird, verlieren die Teilchen Energie. Sie bewegen sich immer langsamer. Wenn sie einander stoßen, haben sie nicht genug Energie, um wieder auseinander zu springen. Sie bleiben nah beieinander und aus dem Gas wird eine Flüssigkeit. Wenn die Flüssigkeit weiter gekühlt wird, verlangsamen die Teilchen noch mehr. Abgesehen von kleinen Schwingungen bewegen sie sich nicht mehr und aus der Flüssigkeit wird ein Feststoff.
Zustandsänderungen sind umkehrbare Vorgänge
In seinem festen Aggregatzustand besitzt ein Stoff eine Form, denn die Teilchen sind an bestimmte Orte gebunden. Deshalb können sie sich nur in Form einer Pendelschwingung auf ihren Plätzen bewegen. Beim Abkühlen wird diese Schwingung immer schwächer und kommt am absoluten Nullpunkt ganz zum Stillstand. Bei der Erwärmung wird diese Bewegung wieder stärker und kann dazu führen, dass Teilchen ihre Plätze verlassen und der Stoff flüssig wird (er schmilzt). Kühlt man ab, wird der Stoff wieder fest (er erstarrt).
Flüssigkeiten haben keine bestimmte Form und ihre Teilchen sind gegeneinader verschiebbar: sie gleiten aneinander vorbei. Die Kräfte, die eine Flüssigkeit zusammenhalten, sind kleiner als bei festen Stoffen. Erhitzt man eine Flüssigkeit, kann die Bewegung ihrer Teilchen so stark werden, dass sie der Flüssigkeit entweichen. Zu diesem Zeitpunkt siedet der Stoff und geht in den gasförmigen Aggregatzustand über. Teilchen von Gasen halten nicht mehr zusammen und bewegen sich frei und völlig regellos im Raum. Dabei stoßen sie pro Sekunde und Teilchen etwa eine Milliarde mal zusammen und auch gegen die Wand ihres Behälters. Diese hohe Geschwindigkeit nimmt beim Abkühlen wieder ab und wenn die Temperatur tief genug ist, dann kondensiert das Gas.
Einige Teilchen eines Stoffes bewgen sich schneller, andere langsamer. Die Wärmebewegung der Teilchen eines Stoffes ist also nicht immer gleich und die besonders rasche Teilchen in einer Flüssigkeit können diese verlassen und in die Luft entweichen. Die Flüssigkeit verdunstet und geht noch unterhalb des Siedepunktes in den Dampfzustand über.
Sublimation und Resublimation
Festes Iod jeht schon bei schwacher Erwärmung, ohne vorher zu schmelzen, in den Dampfzustand über. Den Übergang vom festen in den gasförmigen Zustand nennt man in der Chemie Sublimation. Beim Erkalten des violetten Joddampfes entstehen wieder feine Kristalle. Diesen umgekehrten Fall, bei dem auch kein flüssiger Zustand zu beobachten ist, heißt Resublimation.