24. Der Bau der Atome
Ein experimenteller Beweis für den Atombau
Wissenschaftliche Erkenntnisse können mitunter durch neue, spektakuläre Entdeckungen eine unerwartete Wendung nehmen. Ein gutes Beispiel dafür ist die Erforschung des Atombaus.
Bei der Untersuchung der radioaktiven Strahlen konnte der britische Physiker Ernest Rutherford (1871-1937) im Jahre 1909 den mit »α- Strahlung« bezeichneten Anteil der radioaktiven Strahlung als positiv geladene Atome des Edelgases Helium nachweisen. Rutherford gilt als einer der bedeutendsten Experimentalphysiker. 1902 stellte er die Hypothese auf, dass chemische Elemente durch radioaktiven Zerfall in Elemente mit niedrigerer Ordnungszahl übergehen.

Er teilte 1903 die Radioaktivität in Alphastrahlung, Betastrahlung sowie Gammastrahlung nach der positiven, negativen oder neutralen Ablenkung der Strahlenteilchen in einem Magnetfeld auf und führte den Begriff der Halbwertszeit ein. Diese Arbeit wurde 1908 mit dem Nobelpreis für Chemie ausgezeichnet.
Sein bekanntester Beitrag zur Atomphysik ist das Rutherfordsche Atommodell, das er 1911 aus seinen Streuversuchen von Alphateilchen an Goldfolie ableitete. Rutherfords Mitarbeiter (Hans Geiger und Ernest Marsden) führten einen Versuch mit Strahlen durch. Als Strahlenquelle diente Radium, das sich in einem Bleiblock befand. Eine Bohrung ließ einen Strom von Alpha-Teilchen austreten, der auf eine dünne Goldfolie traf. Erwartungsgemäß durchdrang der allergrößte Teil der alpha-Teilchen die Folie ungehindert. Überraschend war, dass wenige Teilchen (ca. 1 von 8.000) beim Durchfliegen der Metallschicht stark abgelenkt und einzelne sogar zurückgeworfen wurden, als ob sie auf ein massives Zentrum im inneren der Atome gestoßen wären. Dieses massive Zentrum im Inneren des Atoms bezeichnete Rutherford als Atomkern.
Das Kern-Hülle-Modell
Rutherford gelangte nach seinem »Streuversuch« zu dem Schluß, dass der größte Teil der Masse eines Atoms in einem sehr kleinen, positiv geladenen Kern konzentriert ist. Die positive Kernladung wird durch eine entsprechend negative Ladung in einer weit ausgedehnten Atomhülle ausgeglichen (Kern-Hülle-Modell).
Auch auf die Frage, welche Dimensionen ein Atomkern und ein gesamtes Atom haben, lieferten Rutherfords Experimente gute Antworten, so bewegt sich der Durchmesser eines Atoms in der Größenordnung von 10 –10 m, der Durchmesser des Atomkerns beträgt 10 –15 m. Das Verhältnis des Volumens von Atom und des Volumens von Atomkern beträgt demnach 10 15 : 1.
Im Atomkern befinden sich zwei verschiedene Teilchen, die man Protonen und Neutronen nennt. Neutronen besitzen keine elektrische Ladung. Protonen sind jedoch positiv geladen. Infolgedessen ist der Atomkern elektrisch positiv geladen. Beide Teilchen machen mehr als 99,9% der gesamten Masse eines Atoms aus. Daher besitzt die Masse des Atomkerns eine außerordentlich hohe Dichte.
Beispielsweise wiegt 1 cm³ des Schwermetalls Blei 11 g, 1 cm³ Wasserstoffgas wiegt 0,00009 g und 1 cm³ Atomkerne vom Element Wasserstoff wiegt 400.000.000 t !
| Elementarteilchen | Symbol | Ladung | Masse (u) | |
|---|---|---|---|---|
| Atomkern | Proton | p | + 1 | 1,007 (≈ 1) |
| Atomkern | Neutron | n | 0 | 1,009 (≈ 1) |
| Atomhülle | Elektron | e - | - 1 | 0,00055 (fast 0) |
- Kohlenstoffatom mit 6 Protonen und 7 Neutronen
- Eisenatom mit 26 Protonen und 30 Neutronen
- Uranatom mit 92 Protonen und 146 Neutronen.
Dem Proton schreibt man die Ladung + 1 zu. Die daraus resultierende positive Kernladung wird durch die negative Ladung der Atomhülle ausgeglichen. Träger der negativen Ladung sind die Elektronen. Ihre Masse beträgt nur den 1836. Teil eines Protons.
Ein Elektron trägt die Ladung -1. Während die negative Ladung in der Atomhülle weit ausgedehnt ist, ist die positive Ladung auf den winzigen Kern konzentriert. Der Atomkern besitzt deshalb eine außerordentlich hohe Ladungsdichte.
Da die elektrische Ladung des Elektrons bis auf das Vorzeichen gleich der Ladung des Protons ist, muss ein nach außen hin elektrisch neutrales Atom ebenso viele Elektronen in der so genannten Elektronenhülle besitzen, wie Protonen im Kern. Ausschlaggebend für das chemische Verhalten eines Elements ist vor allem die Zahl der Elektronen in der Atomhülle. Jedes Element besteht im Kern aus einer festen Anzahl von Protonen (= Zahl von Elektronen in der Atomhülle). Diese Zahl bezeichnet man als Kernladungszahl oder Ordnungszahl. Dieser Umstand läßt eine exakte Definition des Elementbegriffs zu:
Elemente sind Stoffe, deren Atome alle die gleiche Protonenzahl und damit die gleiche Ordnungszahl besitzen.
Die Isotope
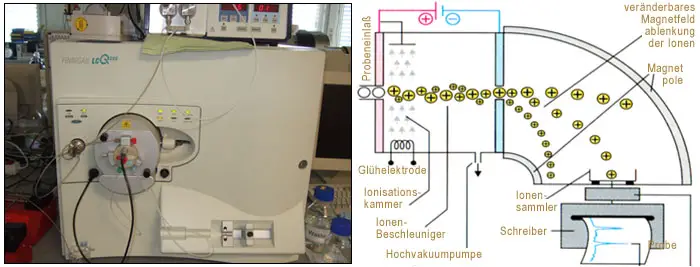
Atommassen werden heute mit der so genannten Massenspektrometrie (Bild 3) ermittelt. Versuche, die nach dieser Methode durchgeführt werden zeigen, dass die meisten Elemente aus Atomen mit verschiedener Masse bestehen.
Da die Atome eines Elements die gleiche Anzahl Protonen besitzen, muß man diese Tatsache darauf zurückführen, dass die Zahl der Neutronen unterschiedlich sein kann. Atome des gleichen Elements, die sich in der Neutronenanzahl und damit in der Masse unterscheiden, bezeichnet man als Isotope.
Die in der Atommassentabelle aufgeführten Atommassen eines Elements sind Mittelwerte der Atommassen der Isotope. Auf die Masse des C-Isotops mit 6 Protonen und 6 Neutronen im Atomkern sind heute alle übrigen Atommassen bezogen. $\tfrac {1} {12}$ der Masse dieses Isotops wurde als atomare Masseneinheit (u) definiert (Kapitel 6).