Metallocene

Als Metallocene bezeichnet man eine Gruppe von metallorganische Verbindungen, in welchen ein zentrales Metallatom wie in einem Sandwich zwischen zwei Cyclopentadienyl-Liganden (C5H5, Abkürzung: Cp) angeordnet ist. Entsprechend werden Metallocene als Sandwichverbindungen bezeichnet. Die Entdeckung des ersten Metallocens, dem Ferrocen, welches 1951 unabhängig von zwei verschiedenen Forschungsteams durch Zufall synthetisiert wurden, gilt heute als einer der Meilensteine in der metallorganischen Chemie und war der Startpunkt für eine rasante Entwicklung einer neuen Sparte der Chemie. Über 80 % der metallorganischen Komplexe sind heute Cyclopentadienyl-Komplexe.[1]
Geschichte
1951 versuchten Tom J. Kealy und Peter L. Pauson an der Duquesne University die Darstellung von Fulvalen durch die Reaktion von Eisen(III)-chlorid mit Cyclopentadienylmagnesiumbromid entsprechend der folgenden Gleichung durchzuführen. Statt des erwarteten Fulvalens erhielten Kealy und Pauson als Hauptprodukt orangefarbene Kristalle, die überraschenderweise an der Luft und bei Temperaturen über 300 °C stabil waren und leicht sublimiert werden konnten.[2]
Die erste Elementaranlyse für Kohlenstoff und Wasserstoff zeigte, dass es sich bei der Verbindung nicht um Fulvalen handeln konnte, und nach einigen Berechnungen kam man auf die Summenformel C10H10Fe. Die qualitative und quantitative Analyse des Eisens gestaltete sich dann aber erstaunlich schwierig, da die Verbindung selbst gegenüber konzentrierter Schwefelsäure beständig war. Erst durch Kochen mit konzentrierter Salpetersäure gelang der qualitative Eisenachweis. Zur quantitativen Analyse musste die Substanz dann sogar mit Perchlorsäure (HClO4) bis zur Trockne abgeraucht werden.[3]
Völlig unabhängig – und zeitlich vor der Arbeit von Tom J. Kealy und Peter L. Pauson – hatten im gleichen Jahr Samuel A. Miller, John A. Tebboth und John F. Tremaine die gleiche Substanz durch die Reaktion von Cyclopentadien-Dampf mit frisch reduziertem Eisen bei 300 °C hergestellt und beschrieben.[4]
Ironischerweise reichten Miller und Kollegen ihre Arbeit sogar vor Kealy und Pauson zur Veröffentlichung ein, aber da Nature, die Fachzeitschrift, in der Kealy und Pauson veröffentlichten, schneller publizierte, wurde deren Beitrag eher veröffentlicht als der von Miller. Laut Miller hatte dieser die Substanz bereits drei Jahre zuvor synthetisiert.[5] Möglicherweise wurde das Ferrocen sogar noch einige Jahre früher bei Union Carbide, welche Versuche zur katalytischen Spaltung von Cyclopentadien in Eisenrohren durchführten, zum ersten Mal hergestellt.[3] Dort wurde es jedoch nie weiter beachtet oder analysiert.

Obwohl die Stabilität der Substanz auf eine andere Art der Bindung, als in den wenigen bis dahin bekannten metallorganischen Verbindungen, wie etwa das Zeise-Salz K[PtCl3(C2H2)], schließen ließ, gingen Kealy und Pauson zunächst von einer rein kovalenten Bindung des Cyclopentadienylringes mit dem Eisen aus und schlugen die nebenstehende Struktur vor. Die Gruppe um Miller ging dagegen von einer eher ionischen Struktur aus. Aufgrund der Infrarotdaten (nur eine C-H-Schwingung, entsprechend nur eine Art der C-H-Bindung im Cp-Ring) und des gefundenen Diamagnetismus folgerten 1952 Geoffrey Wilkinson und Robert B. Woodward an der Harvard University auf eine Art Sandwich-Struktur.[6] Noch im gleichen Jahr bestätigten Ernst Otto Fischer und Wolfgang Pfab in München, sowie Eiland und Pepinsky diese Struktur mittels Röntgen-Kristallstrukturanalyse.[7][8][9] Als Woodward postulierte, dass die Cyclopentadienylringe im Fe(C5H5)2 einer elektrophilen Substitution zugänglich sein sollten, führten Whitning und Rosenblum die erste Friedel-Crafts-Acylierung am Cyclopentadienylring im Ferrocen durch.[10] Durch dieses für aromatische Substanzen typische Verhalten kam, in Analogie zur englischen Endung -ene für aromatische Substanzen (z. B. Benzene für Benzol), der Namensvorschlag Ferrocen zustande.

Fast in einer Art Wettstreit synthetisierten die beiden Arbeitsgruppen um Ernst Otto Fischer in München und Geoffrey Wilkinson in Harvard in den folgenden Jahren in schneller Folge eine Vielzahl Biscyclopentadienyl-Komplexe anderer Übergangsmetalle, sowie deren Derivate:
- 1952: Nickelocen, Cobaltocen[11], Nickelocenium-Kation, Titanocendibromid, Zirconocendibromid, Vanadocendichlorid, Ruthenocen und das Ruthenocenium-Kation[5][12][13]
- 1953: Chromocen, Rhodocenium-Kation und Iridocenium-Kation[14][15][16]
- 1954: Vanadocen[17], Titanocenhydroxybromid, Magnesocen, Manganocen, Niobocentribromid, Tantalocentribromid und Rhenocenhydrid[5][18][19][20]
In den Jahren 1954 und 1955 wurden die Tricyclopentadienyl-Komplexe von Sc, Y, La und der Lanthanoide Ce, Pr, Nd, Sm, Dy, Er und Yb synthetisiert und beschrieben. Für diese wurde, aufgrund einer raschen und vollständigen Reaktion mit Eisenchlorid zu Ferrocen, eine ionische Struktur vorgeschlagen.[21][22]
Ab 1954 synthetisierten die beiden Arbeitsgruppen sogenannte Halbsandwichkomplexe, welche nur einen Cyclopentadienyl-Liganden enthalten, wie etwa (C5H5)V(CO)4, (C5H5)Mn(CO)3, (C5H5)Co(CO)2, (C5H5)Ni(CO), (C5H5)Mo(CO)3H, [(C5H5)Fe(CO)2]2 und (C5H5)Fe(CO)2Cl.[5][23] Auch über die durch Carbonyl-Liganden (CO) verbrückten Halbsandwich-Komplexe (C5H5)Mo(CO)6Mo(C5H5) und (C5H5)W(CO)6W(C5H5) wurde berichtet.[16] Diese Halbsandwich-Verbindungen gehören, im Sinne der Definition, streng genommen, aber nicht zu den Metallocenen. Neben Metallocenen mit (unsubstituierten) Cyclopentadienyl-Liganden wurden bis heute eine große Zahl von Komplexen mit substituierten Ringen hergestellt. Von großem Interesse ist insbesondere der Pentamethylcyclopentadienyl-Ligand (Abkürzung: Cp*), weil er durch seinen großen Raumanspruch instabile Metallocene sterisch stabilisieren und dadurch isolierbar machen kann.
1973 erhielten Ernst Otto Fischer und Geoffrey Wilkinson für ihre Arbeiten über metallorganische Verbindungen, und die Aufklärung der Bindungsverhältnisse im Ferrocen den Nobelpreis für Chemie.[24]
Strukturelemente
Die Cyclopentadienyl-Liganden können, je nach Komplex und Zentralatom, auf verschiedene Art gebunden sein – man spricht hier von Haptizität. η5 (pentahapto) entspricht der am häufigsten auftretenden gleichmäßigen Bindung über 5 Atome. Bei η1 wird nur ein Ringatom für die Bindung benutzt. Die anderen Strukturen mit η2, η3 und η4 existieren ebenfalls, sind aber sehr viel seltener.[25] Die klassische Sandwichstruktur ist den Metallocenen der ersten Reihe der Übergangsmetalle von Vanadium bis Nickel, der Eisen-Gruppe (Eisen, Ruthenium, Osmium) sowie wenigen anderen Metallen, incl. Hauptgruppenelementen vorbehalten.[26] η5,η5-Sandwichkomplexe können in zwei Konformationen, ekliptisch und gestaffelt, auftreten. Die Rotationsbarriere zwischen den beiden Konformeren ist bei unsubstituierten Cp-Ringen nur sehr gering; die Aktivierungsenergie beträgt bei Ferrocen, Ruthenocen und Osmocen zwischen 8 und 21 kJ·mol−1.[26] Die Metallocene der frühen Übergangsmetalle neigen dazu, keine klassischen Sandwichstruktur auszubilden, da diese Elektronenmangelverbindungen sind (sie haben deutlich weniger als 18 Valenzelektronen). Durch Abwinkelung der Cp-Ringe auf einen Winkel von 130° kann das zentrale Metallatom bis zu drei weitere Liganden tragen, wodurch sich die Anzahl der Valenzelektronen erhöht.[26] Die Stabilisierung der klassischen Sandwichstruktur gelingt dann z. B. durch die Verwendung von sterisch anspruchsvollen Liganden, Pentametylcyclopentadienyl (Cp*).
Werden in Metallocenen die Cyclopentadienylringe durch Kohlenwasserstoffbrücken verbunden, ergibt sich die Verbindungsklasse der Metallocenophane, von denen der erste Vertreter, das [4]Ferrocenophan, 1958 von Arthur Lüttringhaus et. al synthetisiert wurde.[27][28]
Bindungsmodelle
18-Elektronen-Regel
Die 18-Elektronen-Regel für die Übergangsmetallelemente ist das Äquivalent zur Oktettregel der Hauptgruppenelemente und kann dazu herangezogen werden, die Stabilität von organometallischen Verbindungen vorherzusagen. Sie besagt, dass organometallische Moleküle oder Komplexe in denen die Summe der Valenzelektronen des Metalls plus die Bindungselektronen, welche von den Liganden beigesteuert werden, insgesamt 18 beträgt besonders stabil sind. Beim Fe(η5-C5H5)2 ergibt sich die Anzahl der Valenzelektronen zu
Durch die 18-Elektronen-Regel können sowohl die hohe Stabilität des Ferrocens[2] als auch die des Cobaltocenium- und des Rhodocenium-Kations gut erklärt werden[11] – alle drei Moleküle sind zueinander isoelektronisch und haben 18 Valenzelektronen. Auch kann die Reaktivität von Rhodocen und Cobaltocen erklärt werden. Beide Komplexe haben 19 Valenzelektronen, was dazu führt, das Rhodocen nur sehr schwierig aus einer Rhodocenium-Lösung isoliert werden kann.[15] Anders als die Stabilität können die Bindungsverhältnisse und die Strukturen in metallorganischen Komplexen durch die 18-Elektronen-Regel nicht erklärt werden.
Kristallfeldtheorie und Ligandenfeldtheorie
Die Kristallfeldtheorie liefert ein qualitatives Verständnis und die Ligandenfeldtheorie erlaubt quantitative Voraussagen über die Eigenschaften von Übergangsmetallsalzen oder -komplexen. Beide Theorien erklären Struktur, Farbe und Magnetismus dieser Substanzen. Beide Theorien betrachten dabei, wie die d-Orbitale des Komplexzentrums durch die Liganden energetisch beeinflusst werden. In einem unkomplexierten Zentralatom sind alle d-Orbitale energetisch entartet, d.h. sie besitzen alle die gleiche Energie. Je stärker ein Ligand mit einem d-Orbital in Wechselwirkung tritt, desto stärker wird dieses energetisch destabilisiert (angehoben), was dann zu einer energetischen Aufspaltung der d-Orbitale führt. Bei den Metallocenen kommt es zu einer 2-1-2 Aufspaltung: die Orbitale in der xy-Ebene (dxy und dx2-y2) treten kaum in Wechselwirkung mit den Cp-Liganden und sind daher energetisch begünstigt. Das dz2 Orbital tritt nur mit einem Teil in Wechselwirkung und liegt in der Mitte. Am stärksten destabilisiert werden die Orbitale dxz und dyz, die vollständig zu den Ringen zeigen.
Molekülorbitaltheorie
Weder die 18-Elektronen-Regel noch die Kristallfeldtheorie für sich allein können die Eigenschaften des Ferrocens im vollen Umfang erklären. Erst durch die Entwicklung der Molekülorbitaltheorie (MO-Theorie) war es möglich, Struktur und Stabilität des Ferrocens in einem Modell zu erklären.[29]
Bei der MO-Theorie werden, ebenso wie bei der Kristall- bzw Ligandenfeldtheorie, Wechselwirkungen der Metall-Orbitale mit den Ligand-Orbitalen betrachtet. Das Ergebnis ist ein Molekülorbital-Diagramm, welches bindende, nicht-bindende und antibindende Orbitale enthält. Wie in der Kristallfeldtheorie resultiert die energetische Aufspaltung der Orbitale dabei aus der Wechselwirkung zwischen Metall- und Ligand-Orbitalen. Treten beispielsweise ein Ligandorbital des Cp-Ringes und ein d-Orbital des Metalls in Wechselwirkung, entstehen daraus zwei neue Molekülorbitale (MOs), welche energetisch in ein bindendes und ein antibindendes MO aufgespalten werden. Die Stärke der Aufspaltung (die energetische Anhebung des einen und Absenkung des anderen MOs) ist dabei umso größer, je stärker die Wechselwirkung (räumliche Überlappung) zwischen Ligand- und Metallorbital ist. Findet keine Wechselwirkung statt, ändert sich das entsprechende Orbital energetisch nicht und es ergibt sich ein nichtbindendes Orbital. Auch bei der MO-Theorie werden die Orbitale, die in Richtung der Liganden zeigen, am stärksten beeinflusst. Je mehr bindende MOs nun mit Elektronen besetzt sind, desto stärker wird die Bindung zwischen Metall und Ligand und desto stabiler wird damit der Komplex. Mit 18 Valenzelektronen sind alle bindenden MOs besetzt und der Komplex hat die höchste Stabilität.
Die nebenstehende Grafik zeigt das MO-Diagramm des Ferrocens, welches mit 18 Elektronen besetzt ist. Die MO-Diagramme anderer Sandwichkomplexe sehen prinzipiell ähnlich aus, wenngleich die einzelnen Energieniveaus der Orbitale sich von Metall zu Metall unterscheiden. In Cobaltocen und Nickelocen sind die antibindenden e*1g-Orbitale mit einem bzw. zwei ungepaarten Elektronen besetzt, was zu einer Destabilisierung der M-Cp-Bindung und zu einer Aufweitung des M-C-Abstandes führt (Fe = 204 pm, Co = 211 pm, Ni = 218 pm).[30] Verändert sich die Geometrie des Komplexes oder die Ladung des Zentralatoms kann sich dadurch ebenfalls die Reihenfolge der Molekülorbitale umkehren.[31]
Gruppe 1 Alkalimetallocene
Die erste Alkalicyclopentadienylverbindung, Kaliumcyclopentadienid, wurde bereits 1901 von J. Thiele hergestellt, dessen Struktur konnte aber erst 1997 durch F. Olbrich aufgeklärt werden.[32] Im Kristall bilden Kalium- und Cp-Ionen eine lineare Kettenstruktur, in der die Cp-Ringe jeweils gegeneinander abgewinkelt und die Kaliumatome zentral über den Ringen platziert sind.[32] Vergleichbare Strukturen findet man in den Kristallen von RbCp und CsCp. Im Gegensatz dazu bilden LiCp und NaCp eine ideale lineare Kette mit einer parallelen Anordnung der Cp-Ringe.[32][33] Die gemessenen Bindungswinkel zu den Cp-Ringen liegen im LiCp und NaCp bei 180° und verringern sich bei den schwereren Homologen: Kalium 138°, Rubidium 132° und Cäsium 130°.[33]
Generell lassen sich Cyclopentadienylalkali-Verbindungen durch Reaktion von 2,4-Cyclopentadienbrom mit Alkaliorganylen oder durch Reduktion von Cyclopentadien mit dem metallischen Alkalimetall darstellen:[34]
Der Sandwichkomplex Lithocen existiert nur in Komplexen in Form des anionischen Lithoceniumions und kann z. B. durch Reaktion von LiCp mit Tetraphenylphosphoniumchlorid (PPh4Cl) hergestellt werden:[34]
Im Lithoceniumion nehmen die beiden Cp-Ringe eine gestaffelte Konformation, mit einem Li-Cp-Abstand von 201 pm, ein.[35][36][37] Aufgrund der Schrägbeziehung im Periodensystem sind Lithocen-Komplexe in Struktur und Reaktionen dem weiter unten beschriebenen Magnesocen ähnlich. Organolithiumkomplexe haben neben der ionischen Bindung einen deutlich kovalent Anteil, welcher zu einer starken Verzerrung der Struktur des Carbanions führen kann. Dieser kovalente Anteil nimmt bei den schwereren Homologen stark ab und bereits beim Kalium findet sich eine fast ausschließlich ionische Bindung.[34]
In neuerer Zeit wurden erste Natrocenium-Komplexe beschrieben. Deren Isolierung gelingt durch den Einsatz von Kronenethern, welche mit Natriumionen komplexe Kationen bilden.[32] Sandwichkomplexe der schwereren Homologen Kalium, Rubidium und Cäsium sind bisher nicht bekannt.
Gruppe 2 Erdalkalimetallocene
Von allen Erdalkalimetallen wurden Biscyclopentadienylkomplexe synthetisiert.[1][38]
Herstellung
Magnesocen wurde bereits 1954 unabhängig voneinander von Ernst Otto Fischer und Geoffrey Wilkinson synthetisiert.[39][40] Es kann durch Disproportionierung von CpMgBr bzw. durch Reaktion von metallischem Magnesium mit Cyclopentadien bei 500 °C gewonnen werden. Für erstere Reaktion wurde zunächst Cyclopentadienylmagnesiumbromid durch Umsetzung von Ethylmagnesiumbromid mit Cyclopentadien hergestellt, welches dann bei 220 °C und 10−4 mbar zu MgCp2 und MgBr2 disproportioniert:[41]
Für den Labormaßstab ist die Umsetzung von Diorganylmagnesium-Verbindungen, wie Dibutylmagnesium, mit Cyclopentadien möglich.[1]
Beryllocen wurde erstmal 1959 durch Ernst Otto Fischer aus Berylliumchlorid und Alkalicyclopentadienyl synthetisiert.[42]
Die Biscyclopentadienylkomplexe von Calcium [Ca(C5H5)2], Strontium [Sr(C5H5)2] und Barium [Ba(C5H5)2] wurden 1961 ebenfalls von Ernst Otto Fischer erstmals beschrieben. Sie können durch Umsetzung von metallischem Calcium oder Strontium mit Cyclopentadien in THF oder DMF oder durch Reaktion der entsprechenden Hydride von Calcium, Strontium und Barium mit Cyclopentadien gewonnen werden:[38]
Die Cokondensation von metallischen Barium mit Cyclopentadien bei −196 °C liefert eine nahezu Quantitavite Ausbeute.[43]
Eigenschaften
Von den Erdalkalimetallocenen hat nur Magnesocen die klassische Sandwichstruktur.[41][44] E. Weiß konnte zeigen, das Magnesocen im Kristall eine gestaffelte Konformation mit einem Mg-C-Abstand von 230 pm hat; dagegen ist nach A. Haland in der Gasphase die Metall-Cp-Bindung aufgeweitet und das Molekül liegt in ekliptischer Konformation vor.[41][1] Ob die Bindung zwischen Metall und Cp-Ring eher kovalenter oder eher ionischer Art ist, ist noch nicht ganz klar. Die dem Ferrocen analoge Sandwichstruktur lässt nicht zwingend auf eine kovalente Bindung schließen, sie könnte auch durch van-der-Waals-Wechselwirkungen erklärt werden. Für den eher ionischen Charakter sprechen die elektrische Leitfähigkeit in flüssigem Ammoniak, die heftige Hydrolysereaktion sowie die 13C-NMR Verschiebung von 108 ppm (zum Vergleich LiCp = 103,6 ppm; NaCp = 103,4 ppm, FeCp2 = 68,2 ppm).[44][41] Dagegen sprechen 25Mg NMR-Daten eher für eine weitgehend kovalente Bindung.[41]
Beryllocen zeigt je nach Aggregatzustand unterschiedliche Molekülgeometrien. In der Tieftemperatur-Röntgenstrukturanalyse zeigt sich eine slipped-Sandwich-Struktur, die Ringe sind gegeneinander versetzt – ein Ring ist η5 koordiniert mit einem Be-Cp-Abstand von 152 pm, der zweite nur η1koordiniert (Be-Cp-Abstand: 181 pm).[45][46] In der Gasphase scheinen beide Ringe η5 koordiniert zu sein. Tatsächlich ist ein Ring deutlich weiter entfernt als der andere (190 und 147 pm) und die scheinbare η5-Koordination ist auf eine schnelle Fluktuation der Bindung zurückzuführen.[44] Der Grund für die η5,η1-Struktur ist, dass die Orbitale des Beryllocens nur mit max. 8 Valenzelektronen besetzt werden können. Ernesto Carmon et al. untersuchten mittels Röntgenstrukturanalyse die Struktur von Be(C5Me4H)2 und Be(C5Me5)2. Dabei fanden sie, dass im Festkörper das Be(C5Me4H)2 eine slipped-Sandwich Struktur mit η5,η1-Koordinierung hat, während das Be(C5Me5)2 eine klassische η5,η5-Koordinierung bevorzugt. Im Kristall sind die B-C-Abstände allerdings nicht gleich lang, sondern variieren zwischen 196,9(1) und 211,4(1) pm.[47]
Mit zunehmender Ordnungszahl steigt der ionische Charakter der Erdalkalimetallocene. Im Kristall hat Ca(C5H5)2 einen polymeren Aufbau, wobei jedes Zentralatom von vier Cp-Liganden umgeben ist.[48] Dabei haben die Cp-Ringe unterschiedliche Haptizität (η5-, η5-, η3-, η1-).[43] Wird als Ligand Pentamethylcyclopentadienyl (Cp*) eingesetzt, können in der Gasphase die Strukturen der isolierten Moleküle durch Elektronenbeugung ermittelt werden.[49] Überraschenderweise zeigt sich hierbei, dass die Moleküle eine abgewinkelte Struktur haben, in denen die Abwinkelung mit steigender Größe des Zentralatoms zunimmt: Mg = 180°, Ca = 154°, Sr = 149°, Ba = 148°.[36] Andere Untersuchungen von Richard Blom et. al. zeigten bei den Pentamethycyclopentadienyl-Komplexen CaCp*2 und YbCp*2 dass die Ebenen um 20° gegeneinander geneigt sind.[50]Für die Abwinkelung wurden verschiedene Modelle herangezogen:[49][33]
- elektrostatisches Modell – die negativen Liganden stören die Kugelsymmetrie der Elektronenhülle am Zentralatom
- Van-der-Waals Wechselwirkung – Triebkraft für die Abwinklung ist der Gewinn an Van-der-Waals-Anziehung zwischen den Liganden
- (n-1)d-Orbital Beteiligung – Bildung von ds-Hybridorbitalen
- ab-initio MO Methoden
Werden sterisch anspruchsvollere Ligangen wie Pentaisopropylcyclopentadienyl (C5iPr5)verwendet, so wird die Abwinkelung wieder aufgehoben (Bsp.: Ba(C5iPr5)2: 180°).[43]
Magnesocen und die schwereren Homologen bilden mit sauerstoff-, stickstoff- und phosphorhaltigen Lewis-Basen entsprechende Addukte.[1] Magnesocen bildet mit Ammoniak oder Aminen 1:1- oder 1:2-Komplexe, welche sich im Falle von primären oder sekundären Aminen isolieren und kristallographisch untersuchen lassen.[51] In diesen Addukten verändert sich die Haptizität eines Cp-Ringes von η5 auf η2.[32][52] Mit 2 THF-Molekülen bildet sich dagegen ein η5,η1-Komplex.[52][1] Der entsprechende Komplex von Barocen mit 2 THF ist dann wiederum ein η5,η5-Komplex.[43]
Verwendung
- Für den Cp Transfer: aufgrund der geringen Stabilität des Magnesocens ist dieses gut zur Cyclopentadienylierung, für die Übertragung von Cp-Einheiten auf andere Metalle, geeignet. Triebkraft ist die Bildung des stabilen Magnesiumdihalogenids.[41]
- zur Beschichtung von Nanopartikeln.[53]
- Magnesocen wird als Polymerisationskatalysator eingesetzt.[51] Aber auch Calcium- und Strontium-Verbindungen scheinen geeignet.[54]
- Barocen kann im ALD-Prozess (atomic layer deposition) zum Auftragen von BaTiO3-Dünnschichten für Widerstände und Kondensatoren eingesetzt werden.[43]
- Magnesocen und dessen Addukte werden im ALE-Verfahren (atomic layer epitaxy) eingesetzt, bei denen z. B. grüne oder blaue LED's hergestellt werden.[1] Auch wird es als Dotierungsmittel bei der Herstellung von p-dotierten Halbleitern im CVD-Verfahren (chemical vapour deposition) verwendet.[51][55]
Gruppe 3 Cyclopentadienylkomplexe der Seltenen Erden
Die Metalle der Seltenen Erden bilden keine klassischen Sandwichkomplexe. Die Komplexe mit der allgemeinen Formel MCp3 werden durch Umsetzung der entsprechenden Halogenide mit Cyclopentadienylnatrium erhalten. Geoffrey Wilkinson und J. M. Birmingham synthetisierten und beschrieben 1956 eine ganze Reihe von Cyclopentadienylkomplexen der Seltenen Erden:[22]
| (C5H5)3M M = |
Farbe | Schmelzpunkt | Farbe (geschmolzen) |
|---|---|---|---|
| Scandium | strohfarben | 240 | rot |
| Yttrium | schwach gelb | 295 °C | grünlich gelb |
| Lanthan | farblos | 395 °C[B 1] | farblos |
| Cer | orange-gelb | 435 °C[B 1] | gelb |
| Praseodym | schwach grün | 415 °C[B 1] | grün |
| Neodym | rotblau | 380 °C | rotblau |
| Samarium | orange | 415 °C | orange |
| Gadolinium | gelb | 350 °C | gelb |
| Dysprosium | gelb | 302 °C | gelb |
| Erbium | pink | 285 °C | pink |
| Ytterbium | dunkelgrün | 273 °C | grün[B 2] |
Anmerkungen B:
Alle Cyclopentadienylkomplexe der Seltenen Erden vom Typ MCp3 haben ähnliche chemische Eigenschaften. Sie sind in Petrolether, Cyclohexan und Benzol nicht und in Pyridin, THF, Ethylenglycoldimethylether und 1,4-Dioxan schwach löslich. Mit Wasser zersetzen sie sich rasch zum Metallhydroxid und Cyclopentadien. Auch beim Luftkontakt zersetzen sie sich rasch. Mit Eisen(II)-chlorid reagieren sie in THF rasch und quantitativ unter Bildung von Ferrocen. Das chemische Verhalten, sowie physikalische Eigenschaften, wie die magnetische Suszeptibilität (welche nahe bei den korrespondierenden Ionen sind) implizieren einen ionischen Charakter der Komplexe.
Allerdings können auch MCp2 Komplexe der seltenen Erden synthetisiert werden. Von diesen sind die Lanthanocen(II)komplexe von Samarium, Europium und Ytterberium am längsten bekannt. Diese neigen dazu, mit Lösungsmitteln wie THF Donorkomplexe von Typ Cp2(THF)2 zu bilden. E.O. Fischer synthetisierte 1964 die Komplexe EuCp2 und YbCp2 im flüssigem Ammoniak und reinigte diese durch Sublimation.[56]. Lösungsmittelfreies SmCp*2 wurde 1984 von William J. Evans hergestellt.[57] 1986 konnte William J. Evans mittels Röngtenstrukturanalysen zeigen, dass SmCp*2 und EuCp*2 eine gewinkelte Sandwichstruktur mit einem Cp-M-Cp Winkel von 140° besitzen.[58]
Gruppe 4 bis 12 Nebengruppenmetallocene
Die Dicyclopentadienyl-Komplexe der Nebengruppenelemente existieren in großer Zahl. Einzig die Verbindungen der Gruppe 8 sind dabei 18-Elektronenkomplexe und daher elektronisch (besonders) stabil. Die Dicyclopentadienyl-Komplexe der anderen Gruppen erfüllen die 18-Elektronenregel nicht, was zur Folge hat, dass diese deutlich instabiler, bzw. reaktiver sind und nicht immer eine ideale Sandwichstruktur bilden. Die elektronenarmen Komplexe der Gruppen 4 bis 7 sind bestrebt, ihren Elektronenmangel durch weitere Liganden auszugleichen. Ohne weitere Reaktionspartner, kann dies durch Dimerisierung oder Oligomerisierung geschehen. Die elektronenreichen Komplexe der 9. bis 12. Gruppe sind dagegen bestrebt, ihren Elektronenüberschuss zu reduzieren. Dies kann durch Oxidation oder durch eine Verringerung der Haptizität eines Liganden geschehen.
Herstellung
Die ersten Metallocene wurden mit einem Grignard-Reagenz hergestellt, später wurde stattdessen bevorzugt das Cylclopentadienylnatrium eingesetzt:[59]
Dabei können auch Metalle mit der Oxidationsstufe +III verwendet werden, welche, im ersten Teilschritt zunächst zur Oxidationsstufe +II reduziert werden, wobei 9,10-Dihydrofulvalen als Nebenprodukt entstehen kann. Aber auch die Verwendung von metallischen Reduktionsmitteln wie Zink wird beschrieben[60]
Im Jahre 1954 versuchte Wilkinson, die Synthese von Bis-Cyclopentadienyl-Metall Komplexen mit Hilfe von Aminen als Halogenwasserstoffakzeptoren durchzuführen.[23] Allerdings waren die Ausbeuten mit 3 – 4 % nur sehr gering. Nur beim Ferrocen oder durch Zugabe stärkerer Basen, wie Kaliumhydroxid lässt sich die Ausbeute deutlich verbessern:
Einzig beim besonders stabilen Ferrocen gelingt es, die Substanz direkt aus Cyclopentadien und dem Metall herzustellen.
Eigenschaften
Von der 4. Periode existieren die Metallocene von Vanadium bis Nickel als isolierbare Verbindungen. Diese sind alle isomorph und haben einen Schmelzpunkt um 173 °C.[61] Von der 5. Periode sind nur die Metallocene von Ruthenium und Rhodium und von der 6. Periode nur das Osmocen isolierbare Verbindungen. Eine Übersicht über die bisher bekannten Metallocene bzw. Dicyclopentadienylkomplexe der Nebengruppenelemente gibt die folgende Tabelle:[62]

| Gruppe | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Valenz- elektronen[A 1] |
14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | ||
| 4. Periode | |||||||||||
| Kurzbezeichnung Name Farbe Schmelzpunkt M-C-Bindungsabstand[30] |
"Cp2Ti"[A 2] Titanocen grün 200 °C (Zers.) … |
Cp2V Vanadocen purpur 167 °C 227 pm |
Cp2Cr Chromocen rot 173 °C 215 pm |
Cp2Mn Manganocen braun 173 °C 211 pm |
Cp2Fe Ferrocen orange 173 °C 204 pm |
Cp2Co Cobaltocen purpur-schwarz 174 °C 211 pm |
Cp2Ni Nickelocen grün 173 °C 218 pm |
[A 3] | "Cp2Zn" Zinkocen … … … | ||
| 5. Periode | |||||||||||
| Kurzbezeichnung Name Farbe Schmelzpunkt M-C-Bindungsabstand |
[A 4] Zirconocen … … … |
"Cp2Nb"[A 2] Niobocen gelb … … |
Cp2Mo[A 5] Molybdocen schwarz … … |
[A 6] | Cp2Ru Ruthenocen hellgelb 195–200 °C 221 pm[31] |
Cp2Rh Rhodocen gelb 174 °C … |
"Cp2Cd" Cadmocen ... ... ... | ||||
| 6. Periode | |||||||||||
| Kurzbezeichnung Name Farbe Schmelzpunkt M-C-Bindungsabstand |
"Cp2Ta"[A 2] Tantalocen … … … |
"Cp2W"[A 2] Wolframocen[A 2] gelb oder grün … … |
Cp2Re Rhenocen … … … |
Cp2Os Osmocen weiß 226-228 °C[63] 219 pm[64], 222 pm[31] |
Cp2Ir Iridocen … … … |
"Cp2Pt"[A 2] Platinocen … … … |
[A 3] | "Cp2Hg" Mercurocen … … … | |||
Anmerkungen A:

Gruppe 4
Titanocen existiert bei Raumtemperatur nur als Dimer, in dem zwei Cyclopentadienylliganden als Fulvalen und die beiden Titanatome zusätzlich über zwei 2-Elektronen-3-Zentren-Wasserstoffbrücken miteinander verbunden sind. Jedes Titanatom besitzt dadurch 16 Valenzelektronen. Durch sterisch anspruchsvollere Liganden wie Pentamethylcyclopentadienyl (Cp*) kann der monomere 14-Elektronenkomplex TiCp*2 synthetisiert werden, welcher in gestaffelter Konformation vorliegt.[65][66] Um die Reaktionen des freiem Titanocen zu untersuchen, kann dieses in-situ z. B. aus TiCp2Cl2 durch Umsetzung mit Magnesium, Lithium oder Natriumamalgan synthetisiert werden.[67]
Gruppe 5
Vanadocen ist ein purpurfarbener, kristalliner, paramagnetischer Feststoff der als 15-Elektronenkomplex instabil ist. Niobocen existiert bei Raumtemperatur nicht als monomerer Sandwichkomplex, sondern dimerisiert als [NbH(C5H5)(C5H4)]2. In dem Dimer hat jedes Niobatom neben den zwei η5-Cp-Liganden eine zusätzliche η1Bindung zu einem Ringkohlenstoffatom des anderen Zentralatoms und einen weiteren Hydrid-Liganden. Zusammen mit der zusätzlich Niob-Niob-Metallbindung hat jedes Metallatom 18-Valenzelektronen.[65]
Gruppe 6
Chromocen ist ein roter kristalliner Feststoff, welcher an der Luft und gegenüber Wasser sehr reaktiv ist und sich unter Umständen bei Luftkontakt spontan entzünden kann.[62][25] Es wird, auf silikatischen Trägersubstanzen aufgebracht, als Katalysator bei der Polymerisation von Ethylen und anderen 1-Alkenen eingesetzt.[68][69] Wie Molybdocen kann auch Wolframocen nur als reaktive Zwischenstufe, z. B. photochemisch aus WCp2H2 oder thermisch aus Wcp2(H)CH3 hergestellt werden.[70] Beide Komplexe sind als Monomere bei Raumtemperatur nicht stabil und dimerisieren unter Bildung von verschiedenen isomeren Zweikernkomplexen.[31]
Gruppe 7
Manganocen ist eine brauner, oberhalb 158 °C rosafarbener Feststoff mit ungewöhnlichen magnetische Eigenschaften. Aufgrund der günstigen high-spin-d5-Konfiguration (jedes d-Orbital ist mit einem Elektron besetzt), kann es nicht zu Mn1- reduziert werden, um die günstige 18-Elektronen-Konfiguration zu erhalten.[71] Im Festkörper liegt Manganocen polymer vor, jedes Mangan ist von drei Cyclopentadienyl-Liganden umgeben. Zwei der drei Liganden sind dabei mit jeweils zwei Manganzentren verbunden, während das dritte nur an ein Manganatom gebunden ist. Die verbrückenden Cyclopentadienyl-Liganden liegen dabei nicht symmetrisch zwischen den Manganatomen.[72] Rhenocen kann durch Photolyse von Re(C5H5)2H in einer Stickstoff- und Argonmatrix bei 12 K hergestellt, isoliert und untersucht werden. Unter diesen Bedingungen liegt der Komplex monomer vor und hat eine Sandwichstruktur.[73]
Gruppe 8
Ferrocen, das einzig luftstabile Metallocen, ist ein diamagnetischer 18-Valenzelektronenkomplex, in welchem das Eisenatom durch die Cp-Ringe sterisch gut abgeschirmt wird. Es ist bei Temperaturen weit über 300 °C beständig.[74]
Gruppe 9
Die 19-Elektronen-Komplexe Cobaltocen, Rhodocen und Iridocen werden leicht zum entsprechenden 18-Elektronen Metallociniumkation oxidiert.[75] Die Oxidationsneigung is dabei so groß, dass bereit organische Halogenide dazu ausreichen:
Cobaltocen dient entsprechend als 1-Elektronen-Reduktionsmittel und kann als Indikatoren für wasserfreie Redoxsysteme verwendet werden. Das Cobaltociuniumkation ist so stabil, dass der Di(methylcyclopentadienyl)-Komplex durch Salpetersäure nicht zerstört, sondern stattdessen die Methylgruppe an aromatischen Ring zur Carbonsäuregruppe oxidiert wird.[75] Rhodocen ist nur bei Temperaturen über 150 °C oder durch Kühlung auf die Temperatur von flüssigem Stickstoff (−196 °C) stabil. Bei Raumtemperatur (25 °C) wandelt sich Rhodocen in Acetonitril in weniger als 2 Sekunden durch Dimerisierung (Kombination) zu [Rh(C5H5)2]2, einem diamagnetischen 18-Valenzelektronen-Komplex um, in welchem zwei Rhodocen-Einheiten über Cyclopentadienylringe miteinander verbunden sind.[76][77][78][79] Dimeres Rhodocen Rh(C5H5)2]2 ist ein gelber Feststoff.
Gruppe 10
Nickelocen ist ein dunkelgrüner, kristalliner Feststoff, der leidlich luftbeständig ist und sich leicht oxidieren lässt. Palladocen und Platinocen, die beiden anderen Komplexe der Gruppe 10, sind bislang nicht bekannt, lediglich die entsprechenden Dikationen konnten mit Hilfe von sperrigen Liganden, wie Cp* synthetisiert werden.[80][81]
Gruppe 11
Metallocene von Kupfer, Silber und Gold konnten noch nicht hergestellt werden; Cu(C5H5)2 und Au(C5H5)2 wurden bisher nur berechnet.[82]
Gruppe 12
Zinkocen wurde zuerst 1969 durch Ernst Otto Fischer beschrieben. Während dieser zunächst eine Sandwich-Struktur annahm, konnte 1984 durch Röntgenstrukturanalyse nachweisen werden, das es in einer Kettenstruktur polymerisiert, in welcher abwechselnd Cyclopentadienylringe und Zinkatome miteinander verknüpft sind und in der an jedes Zinkatom zusätzlich ein terminaler Cyclopentadienylring gebunden ist. Jeder Cp-Ring ist dabei η2 koordiniert.[83][84] Wenn die Cyclopentadienylringe weitere Substituenten enthalten, ergeben sich monomere Komplexe. Bis(pentamethylcyclopentadienyl)zink ZnCp*2 hat in der Gasphase eine η1,η5-Koordination, welche der Slipped-Sandwich-Struktur des Beryllocens entspricht. In Lösung zeigt es dagegen nur ein 1H-NMR-Signal, was eine schnelle Fluktuation zwischen η1 und η5-Koordinierung der beiden Cp*-Ringe bedeutet.[85] 2003 konnten Arne Haaland et al. zeigen, das Zinkocen ZnCp2 in der Gasphase ebenfalls eine η1,η5 Slipped-Sandwich-Struktur besitzt.[86]
Cadmocen wurde zuerst 1969 von Jörg Lorberth beschrieben. Aufgrund seiner Unlöslichkeit in unpolaren Lösungsmitteln und der hohen Zersetzungstemperatur von > 250 °C wurde angenommen, dass es ebenfalls eine polymere Struktur besitzt.[87] Durch den Einsatz sperriger Substituenten wie iso-Propyl- oder tert.-Butyl konnten von Dirk Bentz momomere Cadmocen-Derivate dargestellt werden, welche eine η1,η1 oder eine η1,η2-Koordinierung der Ringe aufweisen.[83]
Redoxpotentiale und Stabilität
Die relative Stabilität der Metallocene kann bestimmt werden, indem die Redoxpotentiale der einfach geladenen Kationen gegenübergestellt werden. Die Daten der folgende Aufstellung werden gegenüber einer gesättigten Kalomel-Elektrode in Acetonitril bestimmt:
- [Fe(C5H5)2]+ / [Fe(C5H5)2] +0.38 V[88]
- [Co(C5H5)2]+ / [Co(C5H5)2] −0.94 V[76]
- [Rh(C5H5)2]+ / [Rh(C5H5)2] −1.41 V[76]
Diese Daten zeigen die Stabilität des neutralen Ferrocens, sowie der Cobaltocenium- und Rhodocenium-Kationen. Rhodocene wirkt um etwa 500 mV stärker reduzierend als Cobaltocen, was auch bedeutet, dass es sich leichter oxidieren lasst und entsprechend weniger stabil ist.[76] Frühere polarografische Untersuchungen an Rhodocenium perchlorat bei einem neutralen pH-Wert zeigten an einer tropfende Quecksilber-Elektrode ein Signal bei −1.53 V (gegenüber einergesättigten Kalomel-Elektrode), entsprechend der Bildung von Rhodocen in Lösung; trotzdem waren es den Forscher nicht möglich das neutrale Rhodocen zu isolieren. In der gleichen Untersuchung versuchten sie Iridocen unter oxidierenden Bedingungen aus Iridocenium Salzen nachzuweisen, was aber auch bei erhöhten pH-Werten nicht gelang.[15] Diese Ergebnisse zeigen, dass das Rhodocen sehr instabil ist aber weisen auch darauf hin, dass das Iridocen sogar noch instabiler ist.
Nebengruppenmetallocenhalogenide
Darunter versteht man Biscyclopentadienyl-Metall-Dihalogenide (Cp2MX2, X = Halogen) sowie deren Derivate, wie Zirconocen hydrochlorid (Schwartz-Reagenz). Diese Verbindungsklasse hat große Bedeutung in der katalytischen Polymerisation von Olefinen erlangt. Sind beide Cyclopentantadienylringe kovalent miteinander verbunden (z. B. durch eine C2H4-Einheit) nennt man die resultierenden Komplexe ansa-Metallocene oder Metallocenophane. Mit Hilfe C2-chiraler ansa-Metallocene (sogenannter Brintzinger-Typ, benannt nach Hans-Herbert Brintzinger, s.u.) gelingt die stereospezifische Olefin-Polymerisation.
Verwendung
als Polymerisationskatalysatoren
Die heute mit Abstand wichtigste Anwendung für Metallocene und deren Derivate ist ihr Einsatz als Polymerisations-Katalysatoren zur Herstellung von Polyolefinen.[89]
Seit den 1950er Jahren werden Ziegler-Natta-Katalysatoren zur Polymerisation von Olefinen, wie Ethylen oder Propylen bei niedrigen Drücken und Temperaturen eingesetzt. Dabei wird in einem mehrstufigen Additions-Insertions-Mechanismus das Olefin zunächst an einen titanorganischen Komplex angelagert und dann in die Titan-Kohlenstoff-Bindung eingebaut. An die dabei freiwerdende Koordinationsstelle wird dann das nächste Olefin angelagert und die Kettenreaktion schreitet durch den Einbau des Olefins in die Titan-Kohlenstoffbindung weiter fort. Die klassischen Ziegler-Natta-Katalysatoren sind Mischkatalysatoren, welche aus einer metallorganischen Hauptgruppen-Verbindung der Gruppen I, II oder III (z.B. Triethylaluminium) und einer Übergangsmetallverbindung, hauptsächlich der Gruppen IV bis VI (z.B. Titantetrachlorid), bestehen. Sie haben jedoch den entscheidenden Nachteil, dass sie in der Regel als heterogene Katalysatoren auf einem Trägermaterial eingesetzt werden, da sie in organischen Lösungsmitteln nicht löslich sind. Dadurch spielen neben den eigentlichen Katalysatoreigenschaften auch die Eigenschaften des Trägermaterials, die Diffusiongeschwindigkeit des Olefins und andere Adsorptionreaktionen eine Rolle. 1982 entdeckte Patricia Wilson, dass das löslichen LuCp*2CH3 als Polymerisations-Katalysator für Ethylen und Propylen auch in Abwesenheit eines Coinitiators fungiert. [90]
1980 beschrieben Hansjörg Sinn und Walter Kaminsky die katalytische Polymerisationsreaktionen von Mischungen der Metallocendihalogeniden (Typ 1) mit Methylaluminoxan (MAO). Diese Kaminsky-Katalysatoren erlauben die Polymerisation von Ethylen, Propylen oder Olefin-Mischungen mit sehr hoher Produktivität.[91] Fünf Jahre später beschrieben Walter Kaminsky und Hans-Herbert Brintzinger, dass bei der Verwendung von ansa-Metallocenen vom Typ 2 Polypropylen mit streng isotaktischer Anordnung hergestellt werden kann.[92] Durch Vergrößerung der organischen Reste an den Cp-Ringen (wie in Typ 3) und/oder Variationen der Brückenatome lassen sich Aktivität und Selektivität gezielt beeinflussen und optimieren.[89]
in der Tumortherapie
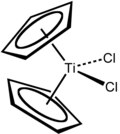
Viele Metallocen-Derivate der frühen Übergangsmetalle haben keine klassische Sandwichstruktur. Stattdessen ist die Cp-M-Cp Achse oft auf rund 130° abgewinkelt, da sie bis zu drei weitere Liganden tragen. Dadurch ist deren Zentralatom für Reaktionspartner leichter zugänglich und reaktiver, was sich unter anderem auch in einer erhöhter Bioaktivität bemerkbar machen kann. So zeigen die Titanocen-, Molybdocen-, Niobocen, Vanadocen- und Rhenocen-Derivate, vom Typ MCp2Cl2 eine zytostatische Wirkung.[93] In Untersuchungen wurde nachgewiesen, dass insbesondere Derivate von Titanocendichlorid TiCp2Cl2 in der Tumortherapie gegenüber Cisplatin eine verbesserte Wirksamkeit bei deutlich geringerer Toxizität besitzt.[94][95][96] Zusätzlich zeigen diese Wirksamkeit auch bei Krebsarten, welche im Laufe der Therapie Resistenzen gegenüber Cisplatin entwickelt können, was eine weitere Therapie bei erneutem Auftauchen von Krebszellen erschwert.[97] Andere Untersuchungen zeigten, dass kationische Komplexe von Niobocendichlorid und Molybdocendichlorid im Vergleich zu Titanocendichlorid eine weiter verbesserte Wirksamkeit haben.[93]
in der Sensortechnik
Aufgrund der herausragenden strukturellen Stabilität des Ferrocens, sowohl in seiner neutralen Form als auch als Ferroceniumkation, eignet sich Ferrocen hervorragend sowohl für die Messung von Redoxpotentialen als auch als Partner in Redoxreaktionen. Fixiert man z. B. eine Kombination eines Ferrocenderivates mit dem Enzym Glukoseoxidase auf einer Elektrodenoberfläche, so lässt sich bei Anwesenheit von Glukose in einer physiologischen Flüssigkeit beim Anlegen eines elektrischen Potentials ein Strom messen. Durch den Vergleich mit einer Eichkurve lässt sich daraus z. B. bei Diabetikern direkt der Glukosegehalt im Blut bestimmen. Bindet man an Ferrocen eine funktionelle Gruppe welche Kationen komplexiert, so verändert sich in Gegenwart eines Kations das Redoxverhalten dieses Ferrocenderivates. Reagiert die funktionelle Gruppe (ausschließlich) mit einem bestimmten Kation, so erhält man einen selektiven Sensor für dieses Kation.[30] In neuerer Zeit finden Ferrocenderivate auch Anwendung in nichtlinearen Optiken.[30]
Andere Metallocenderivate
Halbsandwichkomplexe
Im weiteren Sinn werden unter dem Begriff Metallocenverbindungen auch Halbsandwich-Verbindungen verstanden, die nur ein Cyclopentadienyl-System über π-Bindungen an ein zentrales Metallatom gebunden besitzen. Die Absättigung freier (Elektronen-)Valenzen erfolgt zumeist über Carbonylgruppen (z. B. Tricarbonyl(η5-cyclopentadienyl)mangan).
Weitere Metallocene
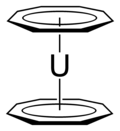
Zur Verbindungsklasse der Metallocene zählen manche Lehrbücher ebenfalls das Uranocen, obwohl es sich hierbei nicht um einen Bis(cyclopentadienly)-, sondern um einen Bis(cyclooctatetraenyl)-Komplex des Urans handelt.
Siehe auch
Literatur
- Arnold F. Holleman, Egon Wiberg, Nils Wiberg: Lehrbuch der anorganischen Chemie. de Gruyter, 1995, ISBN 3-11-012641-9 (Seite 1699–1703 in der Google Buchsuche).
- http://www.uni-marburg.de/fb15/ag-sundermeyer/lehre/matrialien/AC-4.pdf , S. 148–151 (PDF, 1,7 MB)
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 Anja Jaenschke: Basenaddukte des Magnesocens, Dissertation 2006 (pdf, 6.8 MB).
- ↑ 2,0 2,1 T. J. Kealy, P. L. Pauson: A New Type of Organo-Iron Compound. In: Nature. 168, Nr. 4285, 1951, S. 1039–1040, doi:10.1038/1681039b0.
- ↑ 3,0 3,1 Peter L. Pauson: Ferrocene—how it all began, in: J. Organomet. Chem., 2001, 637–639, S. 3–6; (PDF, 103 kB).
- ↑ Samuel A. Miller, John A. Tebboth, John F. Tremaine: Dicyclopentadienyliron. In: J. Chem. Soc.. 1952, S. 632–635, doi:10.1039/JR9520000632.
- ↑ 5,0 5,1 5,2 5,3 F. Albert Cotton: Cyclopentadienyl–metal chemistry in the Wilkinson Group, Harvard, 1952–1955, in: J. Organomet. Chem., 2001, 637–639, S. 18–26; (PDF, 275 kB).
- ↑ Geoffrey Wilkinson, M. Rosenblum, M. C. Whiting, R. B. Woodward: The Structure of Iron Bis-cyclopentadienyl. In: J. A. Chem. Soc.. 1952, S. 2125–2126, doi:10.1021/ja01128a527.
- ↑ Pierre Laszlo, Roald Hoffmann: Ferrocen: objektive Geschichte oder eine Rashomon-Erzählung?. In: Angewandte Chemie. 112, Nr. 1, 2000, S. 127–128, doi:10.1002/(SICI)1521-3757(20000103)112:1<127::AID-ANGE127>3.0.CO;2-2.
- ↑ P. F. Eiland, R. Pepinsky: In: J. Am. Chem. Soc.. 74, Nr. 19, 1952, S. 4971, doi:10.1021/ja01139a527.
- ↑ J. Dunitz, L. Orgel, A. Rich: The crystal structure of ferrocene. In: Acta Crystallographica. 9, Nr. 4, 1956, S. 373–375. doi:10.1107/S0365110X56001091.
- ↑ R. B. Woodward, M. Rosenblum, M. C. Whiting: A NEW AROMATIC SYSTEM. In: J. Am. Chem. Soc.. 74, Nr. 13, 1952, S. 3458–3459, doi:10.1021/ja01133a543.
- ↑ 11,0 11,1 E. O. Fischer, W. Pfab: Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels. In: Z. Anorg. Allg. Chem.. 7, Nr. 6, 1952, S. 377–379. doi:10.1002/zaac.19532740603.
- ↑ G. Wilkinson: The Preparation and Some Properties of Ruthenocene and Ruthenicinium Salts. In: J. Am. Chem. Soc.. 74, Nr. 23, 1952, S. 6146–6147, doi:10.1021/ja01143a538.
- ↑ G. Wilkinson, P. L. Puason, J. M. Birmingham, F. A. Cotton: Bis-cyclopentadienyl Derivates of some Transition Elements. In: J. Am. Chem. Soc.. 75, Nr. 4, 1953, S. 1011–1012, doi:10.1021/ja01100a527.
- ↑ E. O. Fischer, W. Hafner: Z. Naturforsch. 1953, 8b, S. 444–445.
- ↑ 15,0 15,1 15,2 F. A. Cotton, R. O. Whipple, G. Wilkinson: Bis-Cyclopentadienyl Compounds of Rhodium(III) and Iridium(III). In: J. Am. Chem. Soc.. 75, Nr. 14, 1953, S. 3586–3587.
- ↑ 16,0 16,1 G. Wilkinson: Cyclopentadienyl Compounds of Chromium, Molybdenum and Tungsten. In: J. Am. Chem. Soc.. 76, Nr. 1, 1954, S. 209–211, doi:10.1021/ja01630a053.
- ↑ J. M. Birmingham, A. K. Fischer, G. Wilkinson: The Reduction of Bis-cyclopentadienyl Compounds. In: Naturwissenschaften. 42, Nr. 4, 1955, S. 96, doi:10.1007/BF00617242.
- ↑ G. Wilkinson, J. M. Birmingham: Biscyclopentadienylrhenium hydride – a new type of hydride. In: J. Am. Chem. Soc.. 77, Nr. 12, 1955, S. 3421–3422, doi:10.1021/ja01617a098.
- ↑ G. Wilkinson, J. M. Birmingham: Bis-cyclopentadienyl Compounds of Ti, Zr, V, Nb and Ta. In: J. Am. Chem. Soc.. 76, Nr. 17, 1954, S. 4281–4284, doi:10.1021/ja01646a008.
- ↑ L. Friedman, A. P. Irsa, G. Wilkinson: Mass Spectra of Cyclopentadienyl Metal Compounds. Part I. Bis-cyclopentadienyl Compounds of V, Cr, Fe, Co, Ni, Re and Ru, and Manganese and Magnesium Cyclopentadienides. In: J. Am. Chem. Soc.. 77, Nr. 14, 1955, S. 3689–3692, doi:10.1021/ja01619a004.
- ↑ G. Wilkinson, J. M. Birmingham: cyclopentadienyl Compounds of Sc, Y, La, Ce and some Lanthanide elements. In: J. Am. Chem. Soc.. 76, Nr. 23, 1954, S. 6210, doi:10.1021/ja01652a114.
- ↑ 22,0 22,1 G. Wilkinson, J. M. Birmingham: The Cyclopentadienides of Scandium, Yttrium and Some Rare Earth Elements. In: J. Am. Chem. Soc.. 78, Nr. 1, 1956, S. 42–44, doi:10.1021/ja01582a009.
- ↑ 23,0 23,1 J. M. Birmingham, D. Seyferth, G. Wilkinson: A New Preparation of Bis-cyclopentadienyl-Metal Compounds. In: J. Am. Chem. Soc.. 76, Nr. 16, 1954, S. 4179, doi:10.1021/ja01645a038.
- ↑ Press Release: The Nobel Prize in Chemistry 1973. The Royal Swedish Academy of Sciences (1973). Abgerufen am 28. Dezember 2011.
- ↑ 25,0 25,1 Arnold F. Holleman, Egon Wiberg, Nils Wiberg: Lehrbuch der anorganischen Chemie. de Gruyter Verlag, 1995, ISBN 3-11-012641-9 (Seite 1699–1700 in der Google Buchsuche).
- ↑ 26,0 26,1 26,2 Didier Astruc: Organometallic Chemistry and Catalysis. Springer-Verlag, Berlin Heidelberg 2007, 2007, ISBN 978-3-540-46128-9 (Seite 251–270 in der Google Buchsuche).
- ↑ Ulrich T. Mueller-Westerhoff: [m.m]Metallocenophane: Synthese, Struktur, Eigenschaften. In: Angewandte Chemie. 98, Nr. 8, 1986, S. 700–716, doi:10.1002/ange.19860980805.
- ↑ A. Lüttringhaus, W. Kullick: Ansa-Ferrocene. In: Angewandte Chemie. 70, Nr. 14, 1958, S. 438, doi:10.1002/ange.19580701407.
- ↑ R. C. Mehrotra, A. Singh: Organometallic Chemistry: A Unified Approach. 2 Auflage. New Age International, New Delhi 2007, ISBN 978-81-224-1258-1 (Seite 261–267 in der Google Buchsuche).
- ↑ 30,0 30,1 30,2 30,3 Piero Zanelli: Inorganic Electrochemistry theory, pratice and applications. Royal Society of Chemistry, 2003, ISBN 0-85404-661-5 (Seite 159–216 in der Google Buchsuche).
- ↑ 31,0 31,1 31,2 31,3 Christoph Elschenbroich: Organometallchemie. B. G. Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 (Seite 457–458 in der Google Buchsuche).
- ↑ 32,0 32,1 32,2 32,3 32,4 Joachim Paap:Neuartige pi-Organyle der schweren Alkalimetalle und des Magnesiums, Dissertation 2004 (pdf, 4.8 MB)
- ↑ 33,0 33,1 33,2 Robert E. Dinnebier:Kristallstrukturbestimmung molekularer Substanzen aus Röntgenbeugungsaufnahmen an Pulvern (pdf, 4,1 MB)
- ↑ 34,0 34,1 34,2 Erwin Riedel: Moderne Anorganische Chemie. de Gruyter, 2007, ISBN 978-3-11-19060-1 (Seite 622 in der Google Buchsuche).
- ↑ Sjoerd Harder, Marc Heinrich Prosenc: The Simplest Metallocene Sandwich: the Lithocene Anion. In: Angew. Chem. Int. Ed.. 33, Nr. 17, 1994, S. 1744–1746, doi:10.1002/anie.199417441.
- ↑ 36,0 36,1 Dietmar Stalke: The Lithocene Anion and "Open" Calcocene–New Impulses in the Chemistry of Alkali and Alkaline Earth Metallocenes. In: Angew. Chem. Int. Ed.. 33, Nr. 21, 1994, S. 2168–2171, doi:10.1002/anie.199421681., (pdf, 421 kB)
- ↑ Zvi Rappoport, Ilan Marek: The Chemistry of Organolithium Compounds. John Wiley & Sons Ltd., 2004, ISBN 0-470-84339-X (Seite 65–68 in der Google Buchsuche).
- ↑ 38,0 38,1 Ernst Otto Fischer, Georg Stölzle: Erdalkali-di-cyclopentadienyle des Calciums, Strontiums und Bariums. In: Chem. Ber.. 94, Nr. 8, 1961, S. 2187–2193, doi:10.1002/cber.19610940836.
- ↑ E.O. Fischer, W. Hafner, Z. Naturforsch. B9 1954, S. 503.
- ↑ G. Wilkenson, F.A. Cotton, Chem. Ind. (London) 1954, S. 307–308.
- ↑ 41,0 41,1 41,2 41,3 41,4 41,5 Christoph Elschenbroich: Organometallchemie. B. G. Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 (Seite 65–71 in der Google Buchsuche).
- ↑ E. O. Fischer, H. P. Hoffmann: Über Aromatenkomplexe von Metallen, XXV. Di-cyclopentadienyl-beryllium. In: Chem. Ber.. 92, Nr. 2, 1959, S. 482–486, doi:10.1002/cber.19590920233.
- ↑ 43,0 43,1 43,2 43,3 43,4 Kai Fichtel: Metallocen-Verbindungen des Bariums, Dissertation 2004 (pdf, 5,4 MB)
- ↑ 44,0 44,1 44,2 Erwin Riedel: Moderne Anorganische Chemie. de Gruyter, 2007, ISBN 978-3-11-19060-1 (Seite 623 in der Google Buchsuche).
- ↑ Christoph Elschenbroich: Organometallchemie. B. G. Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 (Seite 60 in der Google Buchsuche).
- ↑ J. Huheey, E. Keiter, R. Keiter: Anorganische Chemie. de Gruyter Verlag, 1993, ISBN 3-11-017903-2 (Seite 799 in der Google Buchsuche).
- ↑ María del Mar Conejo, Rafael Fernández, Enrique Gutiérrez-Puebla, Ángeles Monge, Caridad Ruiz, Ernesto Carmona: Synthesis and X-ray Structures of [Be(C5Me4H)2] and [Be(C5Me5)2]. In: Angewandte Chemie. 112, Nr. 11, 2000, S. 2025–2027, doi:10.1002/1521-3757(20000602)112:11<2025::AID-ANGE2025>3.0.CO;2-A.
- ↑ J. Huheey, E. Keiter, R. Keiter: Anorganische Chemie. de Gruyter Verlag, 1993, ISBN 3-11-017903-2 (Seite 794 in der Google Buchsuche).
- ↑ 49,0 49,1 Christoph Elschenbroich: Organometallchemie. B. G. Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 (Seite 70 in der Google Buchsuche).
- ↑ R. A. Andersen, R. Blom, J. M. Boncella, C. J. Burns, H. V. Volden: The Thermal Average Molecular Structures of Bis(pentamethylcyclopentadienyl)magnesium(II), -calcium(II) and -ytterbium(II) in the Gas Phase. In: Acta Chem. Scand. A41, 1987, S. 24-35, doi:10.3891/acta.chem.scand.41a-0024. pdf (4,3 MB)
- ↑ 51,0 51,1 51,2 Aibing Xia, John E. Knox, Mary Jane Heeg, H. Bernhard Schlegel, and Charles H. Winter: Synthesis, Structure, and Properties of Magnesocene Amine Adducts. Structural Distortions Arising from N-H...C5H5 - Hydrogen Bonding and Molecular Orbital Calculations Thereof. In: Organomet.. 22, 2003, S. 4060–4069. (pdf, 260 kB)
- ↑ 52,0 52,1 Zvi Rappoport, Ilan Marek: The Chemistry of Organomagnesium Compounds, Band 2. John Wiley & Sons Ltd., 2008, ISBN 978-0-470-05719-3 (Seite 124–129 in der Google Buchsuche).
- ↑ http://ip.com/patent/EP1073514B1
- ↑ Dissertation Alexandra Steffens:Erdalkalimetallkomplexe zur Polymerisation polarer Monomere, 2005
- ↑ US-Patent 7449404 Method for improving Mg doping during group-III nitride MOCVD
- ↑ E. O. Fischer, H. Fischer: Über Dicyclopentadienyleuropium und Dicyclopentadienylytterbium und Tricyclopentadienyle des Terbiums, Holmiums, Thuliums und Lutetiums. In: J. Organomet. Chem.. 3, Nr. 3, 1965, S. 181–187, doi:10.1016/S0022-328X(00)87500-2.
- ↑ William J. Evans, Laura A. Hughes, Timothy P. Hanusa: Synthesis and crystallographic characterization of an unsolvated, monomeric samarium bis(pentamethylcyclopentadienyl) organolanthanide complex, (C5Me5)2Sm. In: J. Am. Chem. Soc.. 106, 184, S. 4270–4272, doi:10.1021/ja00327a037.
- ↑ William J. Evans, Laura A. Hughes , Timothy P. Hanusa: Synthesis and x-ray crystal structure of bis(pentamethylcyclopentadienyl) complexes of samarium and europium: (C5Me5)2Sm and (C5Me5)2Eu. In: Organomet.. 5, Nr. 7, 1986, S. 1285–1291, doi:10.1021/om00138a001.
- ↑ J. Huheey, E. Keiter, R. Keiter: Anorganische Chemie. de Gruyter Verlag, 1993, ISBN 3-11-017903-2 (Seite 800 in der Google Buchsuche).
- ↑ Didier Astruc: Organometallic Chemistry and Catalysis. Springer-Verlag, Berlin Heidelberg 2007, 2007, ISBN 978-3-540-46128-9 (Seite 251-270 in der Google Buchsuche).
- ↑ J. Huheey, E. Keiter, R. Keiter: Anorganische Chemie. de Gruyter Verlag, 1993, ISBN 3-11-017903-2 (Seite 792 in der Google Buchsuche).
- ↑ 62,0 62,1 Christoph Elschenbroich: Organometallchemie. B. G. Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 (Seite 452 in der Google Buchsuche).
- ↑ Datenblatt Bis(cyclopentadienyl)osmium bei ChemicalBook, abgerufen am 30. Dezember 2011.
- ↑ J. C. A. Bobyens, D. C. Levendis, Michael I. Bruce und Michael L. Williams: Crystal structure of osmocene, Os(η-C5H5)2. In: Journal of Chemical Crystallography. 16, Nr. 4, 1986, S. 519–524, doi:10.1007/BF01161040.
- ↑ 65,0 65,1 Christoph Elschenbroich: Organometallchemie. B. G. Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 (Seite 459 in der Google Buchsuche).
- ↑ Peter B. Hitchcock, Francesca M. Kerton, Gerard A. Lawless: The Elusive Titanocene. In: J. Am. Chem. Soc.. 120, 1998, S. 10264–10265, doi:10.1021/ja981934e.
- ↑ Thomas Janssen: Bis(<eta>1,<eta>5-pentafulven)titankomplexe: Reagenzien für selektive Reaktionen mit N–H-aciden Substraten und Katalysatoren in der intramolekularen Alkenhydroaminierung, Dissertation 2010 (pdf, 7,9 MB
- ↑ Patent DE4306105A1: Modifizierte geträgerte Chromocen-Katalysatorsysteme.
- ↑ Manfred Dieter Lechner, Klaus Gehrke, Eckhard H. Nordmeier: Makromolekulare Chemie: ein Lehrbuch für Chemiker, Physiker. Verlag (Seite 93 in der Google Buchsuche).
- ↑ John F. Hartwig, Xiaoming He: Reaktivität von Wolframocen gegenüber B-B und B-H-Bindungen im Vergleich zu C-H-Bindungen. In: Angewandte Chemie. 108, Nr. 3, 1996, S. 352–354, doi:10.1002/ange.19961080321.
- ↑ Christoph Elschenbroich: Organometallchemie. B. G. Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 (Seite 468 in der Google Buchsuche).
- ↑ Erwin Riedel: Moderne Anorganische Chemie. de Gruyter, 2007, ISBN 978-3-11-19060-1 (Seite 707 in der Google Buchsuche).
- ↑ Jeremy N. Hill, Robin N. Perutz, A. Denise Rooney: Laser-Induced Fluorescence of Rhenocene in Low-Temperature Matrixes: Selective Excitation and Emission. In: J. Phys. Chem.. 99, Nr. 2, 1995, S. 531–537, doi:10.1021/j100002a014.
- ↑ Ivan Ernest: Bindung, Struktur und Reaktionsmechanismen in der organischen Chemie, Springer-Verlag, 1972, ISBN 3-211-81060-9, S. 51.
- ↑ 75,0 75,1 Arnold F. Holleman, Egon Wiberg, Nils Wiberg: Lehrbuch der anorganischen Chemie. de Gruyter Verlag, 1995, ISBN 3-11-012641-9 (Seite 1622 in der Google Buchsuche).
- ↑ 76,0 76,1 76,2 76,3 N. El Murr, J. E: Sheats, W. E. Geiger, J. D. Holloway: Electrochemical Reduction Pathways of the Rhodocenium Ion. Dimerization and Reduction of Rhodocene. In: Inorg. Chem.. 18, Nr. 6, 1979, S. 1443–1446. doi:10.1021/ic50196a007.
- ↑ E. O. Fischer, H. Wawersik: Über Aromatenkomplexe von Metallen. LXXXVIII. Über Monomeres und Dimeres Dicyclopentadienylrhodium und Dicyclopentadienyliridium und Über Ein Neues Verfahren Zur Darstellung Ungeladener Metall-Aromaten-Komplexe. In: J. Organomet. Chem.. 5, Nr. 6, 1966, S. 559–567, doi:10.1016/S0022-328X(00)85160-8.
- ↑ H. J. Keller, H. Wawersik: Spektroskopische Untersuchungen an Komplexverbindungen. VI. EPR-spektren von (C5H5)2Rh und (C5H5)2Ir. In: J. Organomet. Chem.. 8, Nr. 1, 1967, S. 185–188, doi:10.1016/S0022-328X(00)84718-X.
- ↑ B. De Bruin, D. G. H. Hetterscheid, A. J. J. Koekkoek, H. Grützmacher: The Organometallic Chemistry of Rh–, Ir–, Pd–, and Pt–Based Radicals: Higher Valent Species. In: Prog. Inorg. Chem.. 55, 2007, S. 247–354.
- ↑ Helmut Werner, Hans-Jürgen Kraus: Synthese und Strukturdynamik von Bis(cyclopentadienyl)phosphanpalladium-Komplexen. In: Angewandte Chemie. 91, Nr. 12, 1979, S. 1013–1014, doi:10.1002/ange.19790911221.
- ↑ Oleg V. Gusev, Tat'yana A. Peganova, Mikhail G. Peterleitner, Svetlana M. Peregudova, Larisa I. Denisovich, Nikolai A. Ustynyuk: Bis(η5-pentamethylcyclopentadienyl)-and(η5-cyclopentadienyl) (η5-pentamethylcyclopentadienyl)-platinium dications: Pt(IV) metallocenes. In: J. Organomet. Chem.. 480, Nr. 1–2, 1994, S. c16–c17, doi:10.1016/0022-328X(94)87134-5.
- ↑ Diego Carrascal, Lucas Fernández-Seivane, and Jaime Ferrer: Oscillating spin-density pattern in gold metallocene and phthalocyanine molecules. In: Phy. Rev. B. 80, 2009, S. 184415, doi:10.1103/PhysRevB.80.184415.
- ↑ 83,0 83,1 Dirk Bentz: Komplexe von Zink, Cadmiun, Lanthan, Cer und Samarium mit sperrigen Alkylcyclopentadienyl-Liganden, Dissertation 2005, URN: nbn:de:hbz:386-kluedo-19006
- ↑ Peter H.M. Budzelaar, Jaap Boersma, Gerrit J.M. van der Kerk, Anthony L. Spek, Albert J.M. Duisenberg: The structure of dicyclopentadienylzinc. In: J. Organomet. Chem.. 281, Nr. 2–3, 1985, S. 123–130, doi:10.1016/0022-328X(85)87100-X.
- ↑ Christoph Elschenbroich: Organometallchemie. B. G. Teubner Verlag, 2008, ISBN 978-3-8351-0167-8 (Seite 73 in der Google Buchsuche).
- ↑ Arne Haaland, Svein Samdal, Natalya V.Tverdova, Georgii V. Girichev, Nina I.Giricheva, Sergej A. Shlykov, Oleg G. Garkusha, Boris V. Lokshin: The molecular structure of dicyclopentadienylzinc (zincocene) determined by gas electron diffraction and density functional theory calculations: η5,η5, η3,η3 or η5,η1 coordination of the ligand rings?. In: J. Orgonomet. Chem.. 684, Nr. 1-2, 2003, S. 351–358, doi:10.1016/S0022-328X(03)00770-8.
- ↑ J. Lorberth: Organometallverbindungen der iib-elemente: Dicyclopentadienyl-zink, -cadmium und -quecksilber. 19, Nr. 1, 1969, S. 189–190, doi:10.1016/S0022-328X(00)87767-0.
- ↑ V. V. Pavlishchuk, A. W. Addison: Conversion Constants for Redox Potentials Measured Versus Different Reference Electrodes in Acetonitrile Solutions at 25 °C. 298, Nr. 1, Inorg. Chim. Acta, 2000, S. 97–102.
- ↑ 89,0 89,1 Michael Aulbach, Frank Küber: Metallocene – maßgeschneiderte Werkzeuge zur Herstellung von Polyolefinen. In: Chemie in unserer Zeit. 28, 1997, S. 197–208, doi:10.1002/ciuz.19940280410.
- ↑ Didier Astruc: Organometallic Chemistry and Catalysis. Springer-Verlag Berlin Heidelberg 2007, 2007, ISBN 978-3-540-46128-9 (Seite 367-373 in der Google Buchsuche).
- ↑ Hansjörg Sinn, Walter Kaminsky, Hans-Jürgen Vollmer, Rüdiger Woldt: „Lebende Polymere” bei Ziegler-Katalysatoren extremer Produktivität. In: Angewandte Chemie. 92, Nr. 5, 1980, S. 396–402, doi:10.1002/ange.19800920517.
- ↑ Walter Kaminsky, Klaus Külper, Hans H. Brintzinger, Ferdinand R. W. P. Wild: Polymerisation von Propen und Buten mit einem chiralen Zirconocen und Methylaluminoxan als Cokatalysator. In: Angewandte Chemie. 97, Nr. 6, 1985, S. 507–508, doi:10.1002/ange.19850970617.
- ↑ 93,0 93,1 P. Köpf-Maier und T. Klapötke: Antitumor activity of ionic niobocene and molybdenocene complexes in high oxidation states. In: Journal of Cancer Research and Clinical Oncology. 118, Nr. 3, 1992, S. 216-221, doi:10.1007/BF01410137.
- ↑ P. Köpf-Maier: Histologic and ultrastructural alterations of a xenografted human colon adenocarcinoma after treatment with titanocene dichloride. In: Journal of Cancer Research and Clinical Oncology. 114, Nr. 4, 1988, S. 250-258, doi:10.1007/BF00405830.
- ↑ P. Köpf-Maier: Tumor inhibition by titanocene complexes: influence on xenografted human adenocarcinomas of the gastrointestinal tract. In: Cancer Chemotherapy and Pharmacology. 23, Nr. 4, 1989, S. 225-230, doi:10.1007/BF00451646.
- ↑ P. Manohari Abeysinghe and Margaret M. Harding: Antitumour bis(cyclopentadienyl) metal complexes: titanocene and molybdocene dichloride and derivatives. In: Dalton Transactions. 32, 2007, S. 3474-3482, doi:10.1039/B707440A.
- ↑ Alexander Gmeiner: Beiträge zur Chemie von Übergangsmetallkomplexen mit Alkenylcarbenen, Phosphoryliden und bioaktiven Hydroxyverbindungen als Liganden, Dissertation 2010 (pdf, 7,1 MB)

