Shikimisäureweg
| Übergeordnet | ||
| Metabolismus der Carbonsäuren | ||
| Gene Ontology | ||
|---|---|---|
| QuickGO | ||
Der Shikimisäureweg oder Shikimatweg ist die Bezeichnung für einen biochemischen Stoffwechselweg, der in Pflanzen und den meisten Mikroorganismen vorkommt. Er hat grundlegende Bedeutung durch die Biosynthese der proteinogenen aromatischen Aminosäuren Phenylalanin, Tyrosin und Tryptophan. Darüber hinaus liefert er wichtige Ausgangsstoffe für den pflanzlichen Sekundärstoffwechsel.
Reaktionsfolge
Hauptpfad
Im Großen und Ganzen läuft der Shikimisäureweg in den verschiedenen dazu befähigten Organismen ähnlich ab, im Detail existieren jedoch Unterschiede. Deshalb sei darauf hingewiesen, dass sich das folgende Reaktionsschema auf den relativ gut erforschten Shikimisäureweg des Bakteriums Escherichia coli bezieht.[1]
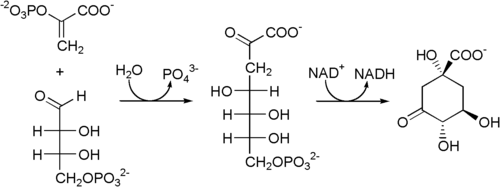
Als Startpunkt des Shikimisäureweges wird die vom Enzym 3-Desoxyarabinoheptulosanat-7-phosphat-Synthase[2] katalysierte Reaktion von Phosphoenolpyruvat und Erythrose-4-phosphat festgelegt. Dabei entsteht 3-Desoxyarabinoheptulosanat-7-phosphat, welches im nächsten Schritt von der 3-Dehydrochinat-Synthase[3] zu 3-Dehydrochinat zyklisiert wird.[4]
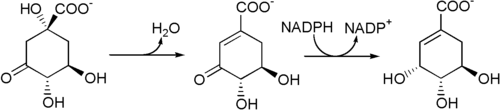
Aus 3-Dehydrochinat entsteht durch eine vom Enzym 3-Dehydrochinat-Dehydratase[5] vermittelte Wasserabspaltung 3-Dehydroshikimat, das danach von der Shikimatdehydrogenase[6] zu Shikimat reduziert wird.[4]

Darauf folgt die ATP-abhängige Phosphorylierung des Shikimats durch die Shikimatkinase[7] zu Shikimat-3-phosphat. Die von der 5-Enolpyruvylshikimat-3-phosphat-Synthase[8] katalysierte Reaktion mit einem weiteren Molekül Phosphoenolpyruvat ergibt dann 5-Enolpyruvylshikimat-3-phosphat.[4]

Nach Abspaltung der Phosphatgruppe durch die Chorismatsynthase[9] wird daraus Chorismat.[4]

Die Chorismat-Mutase katalysiert über eine Claisen-Umlagerung die Umwandlung von Chorismat in Prephenat.[4][10]
Verzweigungen des Syntheseweges


Die Synthesewege der beiden Aminosäuren Tyrosin und Phenylalanin teilen sich erst beim Prephenat. Für die Tyrosinsynthese wird Prephenat durch eine Prephenatdehydrogenase[11] in 4-Hydroxyphenylpyruvat umgewandelt. Im Phenylalaninzweig des Syntheseweges katalysiert die Prephenatdehydratase[12] die Reaktion von Prephenat zu Phenylpyruvat. In einem letzten Transaminierungsschritt entstehen aus den beiden Vorstufen die jeweiligen Aminosäuren Tyrosin und Phenylalanin. Alternativ kann aber auch zuerst Prephenat zu Arogenat transaminiert werden, das dann entweder durch eine Arogenatdehydratase[13] in Phenylalanin oder durch eine Arogenatdehydrogenase[14] in Tyrosin umgewandelt wird.[1][4]
Schon beim Zwischenprodukt Chorismat zweigt der Syntheseweg der aromatischen Aminosäure Tryptophan vom Hauptpfad ab. Im ersten Schritt wandelt die Anthranilatsynthase[15] Chorismat in Anthranilat um, das mittels der Anthranilatphosphoribosyltransferase[16] mit Phosphoribosylpyrophosphat zu N-(5-Phosphoribosyl)-anthranilat reagiert. Eine durch die Phosphoribosylanthranilatisomerase[17] katalysierte Amadori-Umlagerung führt zu 1-(2-Carboxyphenylamino)-1-desoxyribulose-5-phosphat. Die Indol-3-glycerolphosphat-Synthase[18] stellt den Ringschluss zu Indol-3-glycerolphosphat her. Die beiden letzten Teilreaktionen, nämlich die Abspaltung von Glycerinaldehyd-3-phosphat zum Zwischenprodukt Indol und dessen Kondensation mit Serin, katalysiert die Tryptophansynthase[19], was Tryptophan liefert.[1][4]
Biologische Bedeutung
Pflanzen beherrschen als autotrophe Lebewesen den Shikimisäureweg, er ist Teil ihres Primärstoffwechsels, liefert aber auch Vorstufen für sekundäre Pflanzenstoffe. Abgesehen von den proteinogenen aromatischen Aminosäuren Tryptophan, Phenylalanin und Tyrosin resultiert eine Fülle weiterer Substanzen mit aromatischen Ringen letztendlich aus dem Shikimatweg, wobei die nachfolgende Aufzählung keineswegs abschließend ist und der Shikimatweg auch mit anderen Synthesewegen kombiniert sein kann:[1][20]
- Ubichinone und Plastochinone
- Vitamin E, Vitamin K, Folsäure
- Siderophore
- Lignin
- Phenylpropanoide
- Isoflavone, Anthocyane, Lignane, Stilbenoide
- Zimtsäurederivate
- Cumarin, Vanillin
- Benzoesäurederivate (Salicylsäure, Gallussäure, p-Aminobenzoesäure)
- manche Alkaloide (Morphin, Colchicin)
Aber auch bei vielen Bakterien, Pilzen und Protozoen wurde der Shikimisäureweg nachgewiesen.[1][21] Tieren fehlen dagegen die entsprechenden Enzyme. Deshalb sind die Aminosäuren Phenylalanin und Tryptophan für sie essentiell, Tyrosin kann nur direkt aus Phenylalanin synthetisiert werden.[1]
Neben dem Shikimisäureweg existieren weitere Möglichkeiten für die Biosynthese aromatischer Ringstrukturen, wie beispielsweise der Polyketidweg und die Nukleotid-Biosynthese.
Sonstiges
- Die in der Landwirtschaft als Breitbandherbizid eingesetzte Verbindung Glyphosat unterbricht den Shikimisäureweg, indem sie das Enzym 5-Enolpyruvylshikimat-3-phosphat-Synthase (EC 2.5.1.19) hemmt.[4]
- Da vielen Krankheitserregern das Vorhandensein des Shikimisäureweges gemeinsam ist, werden die Enzyme dieses Stoffwechselweges als aussichtsreicher Angriffspunkt bei der Entwicklung von Medikamenten mit sehr breitem Wirkungsspektrum angesehen, das sich auf Bakterien-, Pilz- und Protozoeninfektionen erstreckt.[21]
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 D. E. Metzler: Biochemistry. The Chemical Reactions of Living Cells. Volume 2. Elsevier Science, 2003; S. 1420–1471 ; ISBN 0-12-492541-3.
- ↑ EC 2.5.1.54
- ↑ EC 4.2.3.4
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 J. M. Berg, J. L. Tymoczko, L. Stryer: Biochemie. 6. Auflage. Spektrum Akademischer Verlag, Elsevier GmbH, München 2007; S. 773–775; ISBN 978-3-8274-1800-5.
- ↑ EC 4.2.1.10
- ↑ EC 1.1.1.25
- ↑ EC 2.7.1.71
- ↑ EC 2.5.1.19
- ↑ EC 4.2.3.5
- ↑ EC 5.4.99.5
- ↑ EC 1.3.1.12 und EC 1.3.1.13
- ↑ EC 4.2.1.51
- ↑ EC 4.2.1.91
- ↑ EC 1.3.1.43, EC 1.3.1.78 und EC 1.3.1.79
- ↑ EC 4.1.3.27
- ↑ EC 2.4.2.18
- ↑ EC 5.3.1.24
- ↑ EC 4.1.1.48
- ↑ EC 4.2.1.20
- ↑ P. M. Dewick: Medicinal Natural Products: A Biosynthetic Approach. 3. Auflage, John Wiley & Sons Ltd., 2009; S. 137–186; ISBN 978-0-470-74167-2.
- ↑ 21,0 21,1 C. W. Roberts et al.: The shikimate pathway and its branches in apicomplexan parasites. In: J. Infect. Dis. 185 Suppl. 1, Feb 2002, S. S25–36. PMID 11865437.
Weblinks