Brenztraubensäure
| Strukturformel | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||||||||||
| Name | Brenztraubensäure | ||||||||||||||
| Andere Namen |
| ||||||||||||||
| Summenformel | C3H4O3 | ||||||||||||||
| CAS-Nummer | 127-17-3 | ||||||||||||||
| PubChem | 1060 | ||||||||||||||
| Kurzbeschreibung |
nach Essigsäure riechende, farblose Flüssigkeit[1] | ||||||||||||||
| Eigenschaften | |||||||||||||||
| Molare Masse | 88,06 g·mol−1 | ||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||
| Dichte |
1,27 g·cm−3[2] | ||||||||||||||
| Schmelzpunkt | |||||||||||||||
| Siedepunkt |
Zersetzung bei 165 °C[2] | ||||||||||||||
| pKs-Wert |
2,49[1] | ||||||||||||||
| Löslichkeit |
mischbar mit Wasser[2] | ||||||||||||||
| Sicherheitshinweise | |||||||||||||||
| |||||||||||||||
| LD50 |
3533 mg·kg−1 (Maus, subcutan) [4] | ||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||
Brenztraubensäure, auch Acetylameisensäure, ist die einfachste Ketocarbonsäure, deren Salze und Ester als Pyruvate bezeichnet werden. In der Biochemie bezeichnet Pyruvat das Anion der Brenztraubensäure. Das Molekül der Brenztraubensäure besitzt eine α-ständige Carbonylgruppe. Der Acyl-Rest (CH3COCO-) von Brenztraubensäure wird "Pyruvoyl" genannt.
Darstellung
Die Bezeichnung Brenztraubensäure leitet sich von der ersten Herstellung ab: Weinsäure wurde einer trockenen Destillation unterworfen (das damals so genannte Brenzen); hierbei entsteht Brenztraubensäure nach Decarboxylierung und Abspaltung von Wasser. Im Englischen heißt die Verbindung daher "pyruvic acid", abgeleitet vom griechischen "pyr" (Feuer, Hitze) und dem lateinischen "uva" (Traube, besonders Weintraube).
Jöns Jakob Berzelius hat Brenztraubensäure um 1835 durch gemeinsames Brenzen von Weinsäure mit Kaliumhydrogensulfat dargestellt.
Eigenschaften
Der Flammpunkt der farblosen, mit Wasser beliebig mischbaren Flüssigkeit liegt bei 82 °C.
Biochemische Bedeutung
Das Anion der Brenztraubensäure, Pyruvat, stellt ein wichtiges Zwischenprodukt im aeroben und anaeroben Stoffwechsel dar.
Es entsteht beispielsweise im Cytoplasma einer Zelle, wenn Glucose im Rahmen der Glycolyse zweifach phosphoryliert und abgebaut wird.
Der Abbau läuft über die Zwischenprodukte GAP und Phosphoenolpyruvat.
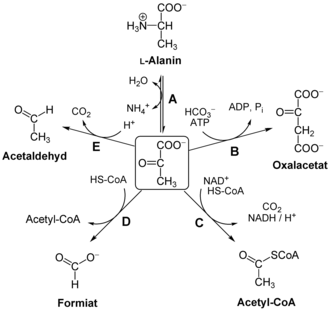
Hierbei gewinnt die Zelle pro Mol Glucose neben 2 Mol Brenztraubensäure noch 2 Mol ATP und 2 Mol NADH+H+. Pyruvat ist eine energiereiche Verbindung und kann im Citratzyklus (auch Zitratzyklus, Zitronensäurezyklus, Tricarbonsäurezyklus oder Krebs-Zyklus genannt) weiter abgebaut werden. Aus den bei der Glycolyse (aus einem Mol Glucose) gewonnenen 2 Mol Pyruvat entstehen in den Mitochondrien der Zelle dabei 6 Mol CO2, 8 Mol NADH+H+, 2 Mol FADH2 und 2 Mol ATP. Durch Transaminierung von Pyruvat (Reaktionspartner L-Glutaminsäure) entsteht L-Alanin (Ala) (vgl. Bild, A). Damit erfolgt die Anbindung an den Stoffwechsel der Aminosäuren (vergl. Glukose-Alanin-Zyklus, eine Variante des bekannten Cori-Zyklus). Gleichzeitig erfolgt bei Pyruvat die Weichenstellung zwischen dem Eintritt über die Pyruvatcarboxylase für die Gluconeogenese (B) oder dem Eintritt in den Citratzyklus über den Pyruvatdehydrogenase-Multienzymkomplex (Energiemangel-Situation, Bildung von Acetyl-CoA) (C) Unter anaeroben Bedingungen kann sie aber auch zu Milchsäure oder Ethanol verstoffwechselt werden (siehe Gärung).
Bei der anaeroben Ameisensäuregärung verstoffwechseln Bakterien Pyruvat mithilfe der Formiatacetyltransferase zu Ameisensäure (D). Im ersten Schritt der alkoholischen Gärung wird Pyruvat bei Pflanzen, Pilzen und einigen Bakterien mittels der Pyruvatdecarboxylase zu Acetaldehyd abgebaut (E). Pyruvat kann mit Hilfe der Lactatdehydrogenase (LDH) zu Lactat reagieren, das im anabolen und katabolen Stoffwechsel weiterverwendet werden kann.
Das Stoffwechselprodukt Brenztraubensäure wird bei Zellschädigungen zum Beispiel toxischer, hypoxischer oder hypovitaminotischer Art in Serum und Harn konzentriert; gleichermaßen erfolgt eine Glykogenverarmung in Leber und Muskulatur.
Nachweis
Der analytische Nachweis kann mit Phenylhydrazin, α- oder β-Naphthol oder 2,4-Dinitrophenylhydrazin durchgeführt werden.
Einzelnachweise
- ↑ 1,0 1,1 Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 Eintrag zu CAS-Nr. 127-17-3 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 06.01.2008 (JavaScript erforderlich).
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Pyruvic acid bei ChemIDplus.
Literatur
- Michael T. Madigan, John M. Martinko, Michael Thomm (Hrsg.): Brock Mikrobiologie. Pearson Studium; 11. überarb. Auflage 2006: ISBN 3-8273-7187-2.
- Jeremy M. Berg, Lubert Stryer und John L. Tymoczko: Biochemie, Spektrum Akademischer Verlag GmbH Heidelberg; 6. Auflage, 2003, ISBN 3-8274-1800-3.
Weblinks