Quadratsäure
| Strukturformel | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||||||||||
| Name | Quadratsäure | ||||||||||||||
| Andere Namen |
3,4-Dihydroxycyclobut-3-en-1,2-dion | ||||||||||||||
| Summenformel | C4H2O4 | ||||||||||||||
| CAS-Nummer | 2892-51-5 | ||||||||||||||
| PubChem | 17913 | ||||||||||||||
| Kurzbeschreibung |
beigefarbener Feststoff[1] | ||||||||||||||
| Eigenschaften | |||||||||||||||
| Molare Masse | 114,06 g·mol−1 | ||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||
| Dichte |
1,82 g·cm−3[1] | ||||||||||||||
| Schmelzpunkt | |||||||||||||||
| pKs-Wert | |||||||||||||||
| Löslichkeit |
gut löslich in Wasser (20 g·l−1 bei 20 °C)[1] | ||||||||||||||
| Sicherheitshinweise | |||||||||||||||
| |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||
Die Quadratsäure ist ein Abkömmling des Cyclobutens, gehört zur Gruppe der Oxokohlenstoffe und ist verwandt mit der Semiquadratsäure (Moniliformin), dem sauersten bekannten Naturstoff. Die Salze der Quadratsäure heißen Quadratate.
Darstellung
Die erste Darstellung von Quadratsäure erfolgte durch Umsetzung von Chlortrifluorethylen mit Zink. Das dabei entstehende Perfluorcyclobuten wird in Ethanol zu 1,2-Diethoxy-3,3,4,4-tetrafluor-1-cyclobuten umgesetzt. Durch saure Hydrolyse entsteht schließlich die Quadratsäure.[5]
Eigenschaften
Der Name Quadratsäure ist eigentlich nicht korrekt, da die vier Kohlenstoffatome aufgrund unterschiedlicher C–C-Bindungslängen kein Quadrat bilden. In kristallinen Zustand ordnen sich die planaren C4O4-Untereinheiten über Wasserstoffbrückenbindungen zu einer ebenen Schicht an.
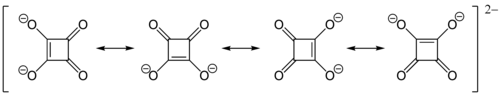
Die hohe Acidität (pKs1 = 1,5, pKs2 = 3,4) der Quadratsäure lässt sich, ähnlich wie z. B. bei der Delta-, Crocon- oder der Rhodizonsäure, durch Resonanzstabilisierung des Anions erklären. Das Dianion der Quadratsäure ist völlig symmetrisch gebaut und zeigt keine unterschiedlichen C–C- bzw. C–O-Bindungslängen:
Ebenso wie bei den Anionen der anderen oben erwähnten Säuren (Oxokohlenstoffe) handelt es sich um ein aromatisches System mit 2 π-Elektronen.[6]
Verwendung
Die Quadratsäure wird in der Chemie, der Industrie und der Medizin verwendet.
Chemie
- Quadratsäure wurde als Baustein zur Synthese von neuen Poly-alkoxo-oxometallat-Derivaten, wie z. B. dem K4[VIV12O12(OCH3)16(C4O4)6] eingesetzt. Dazu wurde ortho-Vanadinsäuremethylester mit Quadratsäure und Kaliumhydroxid unter Solvothermalbedingungen umgesetzt.[7]
- Auch zur Darstellung neuer Organozinnverbindungen wurde Quadratsäure verwendet. So gelang 2004 durch Umsetzung von Trimethylzinnchlorid, Tributylzinnchlorid bzw. Dimethylzinndichlorid mit Dinatriumquadratat die Synthese von Bis(trimethyl)-, Bis(tributylzinn)- bzw. Dimethylzinnquadratat.[8]
Industrie
Von zunehmend industrieller Bedeutung sind von der Quadratsäure abgeleitete Farbstoffe, die Squaraine.
Medizin
Neben Diphenylcyclopropenon (DPCP) wird Quadratsäuredibutylester (SADBE) zur Behandlung des Haarausfalls eingesetzt. Im Rahmen einer topischen Immuntherapie bei therapieresistenter Alopecia areata bzw. Alopecia totalis erfolgt eine gezielte Kontaktsensibilisierung der Kopfhaut mit verdünnter Quadratsäurelösung.[9]
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 Datenblatt Quadratsäure bei Merck, abgerufen am 23. März 2010.
- ↑ 2,0 2,1 Robert West, David L. Powell: „New Aromatic Anions. III. Molecular Orbital Calculations on Oxygenated Anions“, in: J. Am. Chem. Soc., 1963, 85 (17), S. 2577–2579; doi:10.1021/ja00900a010.
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Datenblatt Quadratsäure bei AlfaAesar, abgerufen am 23. März 2010 (JavaScript erforderlich).
- ↑ Sidney Cohen, John R. Lacher, Joseph D. Park: „Diketocyclobutenediol“, in: J. Am. Chem. Soc., 1959, 81 (13), S. 3480–3480; doi:10.1021/ja01522a083.
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006.
- ↑ Johann Spandl, Irene Brüdgam, Hans Hartl: „Von kleinen Bausteinen zu neuen Poly-alkoxo-oxometallat-Derivaten: Synthese und Strukturaufklärung von K4[VIV12O12(OCH3)16(C4O4)6], Cs10[VIV24O24(OCH3)32(C4O4)12][VIV8O8(OCH3)16(C2O4)] und M2[VIV8O8(OCH3)16(VIVOF4)] (M = [N(nBu)4] bzw. [NEt4])“, in: Z. anorg. allg. Chem., 2003, 629 (3), S. 539–544; doi:10.1002/zaac.200390087.
- ↑ Asrial: Synthese und Charakterisierung neuer Organozinnverbindungen, Cuvillier Verlag, Göttingen 2004, ISBN 3-86537-259-7 (eingeschränkte Vorschau in der Google Buchsuche).
- ↑ P. Freyschmidt-Paul, R. Happle, R. Hoffmann: „Alopecia areata – Klinik, Pathogenese und rationale Therapie einer T-Zell-vermittelten Autoimmunerkrankung“, in: Der Hautarzt, 2003, 54, S. 713–722; doi:10.1007/s00105-003-0560-z.