Blei(II)-chlorid
| Kristallstruktur | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||
| __ Pb2+ __ Cl− | ||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||
| Name | Blei(II)-chlorid | |||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||
| Verhältnisformel | PbCl2 | |||||||||||||||||||
| CAS-Nummer | 7758-95-4 | |||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||
| Molare Masse | 278,10 g·mol−1 | |||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||
| Dichte |
5,85 g·cm−3[1] | |||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||
| Siedepunkt |
950 °C[1] | |||||||||||||||||||
| Löslichkeit |
10 g·l−1 in Wasser[1] | |||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||
| ||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||
| ΔHf0 |
−359 kJ·mol−1[5] | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||
Blei(II)-chlorid (PbCl2) ist das Blei(II)-salz der Salzsäure. Es kristallisiert in weißen, rhombischen Nadeln oder Prismen aus.
Vorkommen
In der Natur kommt Blei(II)-chlorid als Mineral Cotunnit vor.
Gewinnung und Darstellung

Blei(II)-chlorid lässt sich durch Reaktion von Blei oder Blei(II)-oxid mit Chlor darstellen.[6]
Da Blei(II)-chlorid in Wasser schwerlöslich ist, fällt es aus bleihaltigen wässrigen Lösungen aus. Dies wird in der Salzsäuregruppe des Kationentrennungsganges ausgenutzt, um Blei von anderen Ionen abzutrennen.[7]
Bemerkenswert dabei ist, dass Blei(II)-chlorid in der Wärme wesentlich besser als in der Kälte löslich ist. Lässt man eine gesättigte, heiße Lösung abkühlen, so fällt beim Abkühlen das Blei(II)-chlorid in Form schön ausgebildeter Nadeln aus. [7]
Eigenschaften

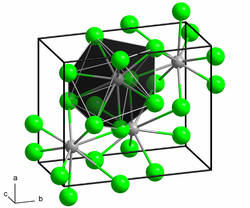
Blei(II)-chlorid kristallisiert wie Blei(II)-fluorid und Blei(II)-bromid in der mit der Uran(III)-chloridstruktur verwandten PbCl2-Raumstruktur. Dabei ist jedes Bleiatom von insgesamt neun Chlorid-Atomen koordiniert. Diese bilden als Koordinationspolyeder verzerrte dreifach überkappte, trigonale Prismen, die über gemeinsame Flächen miteinander verbunden sind.[6]
Während Blei(II)-chlorid in kalter, verdünnter Salzsäure nur sehr gering löslich ist, löst es sich gut in konzentrierter Salzsäure unter Bildung von Chloroplumbaten.[7] Löslich ist es zudem in Ammoniumchlorid und -nitratlösungen, da sich dabei lösliche Doppelsalze bilden.[8]
Verwendung
Blei(II)-chlorid wird zur Herstellung von Bleichromat und als Flussmittel verwendet. Früher wurde es auch zur Herstellung mehrerer Pigmente, Pattinsons Bleiweiß (Bleihydroxidchlorid) und Veroneser Gelb (Bleioxidchlorid) genutzt.[8]
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 Datenblatt Blei(II)-chlorid bei Merck, abgerufen am 19. Januar 2011.
- ↑ 2,0 2,1 Nicht explizit in EU-Verordnung (EG) 1272/2008 (CLP) gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Bleiverbindungen“; Eintrag aus der CLP-Verordnung zu Bleiverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. April 2012 (JavaScript erforderlich)
Referenzfehler: Ungültiges
<ref>-Tag. Der Name „CLP_82810“ wurde mehrere Male mit einem unterschiedlichen Inhalt definiert. - ↑ Eintrag zu CAS-Nr. 7758-95-4 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. März 2011 (JavaScript erforderlich).
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ PAETEC Formelsammlung Ausgabe 2003, Seite 116
- ↑ 6,0 6,1 Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, S. 1013-1015, ISBN 978-3-11-017770-1.
- ↑ 7,0 7,1 7,2 Jander, Blasius, Strähle: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. Hirzel, Stuttgart 1995, S. 245, ISBN 978-3-77-760672-9. Referenzfehler: Ungültiges
<ref>-Tag. Der Name „Jander“ wurde mehrere Male mit einem unterschiedlichen Inhalt definiert. - ↑ 8,0 8,1 Bleichloride in: Roempp Chemie Lexikon, Thieme Verlag, 2009, online