Synaptobrevin
| Synaptobrevin-1 | ||
|---|---|---|
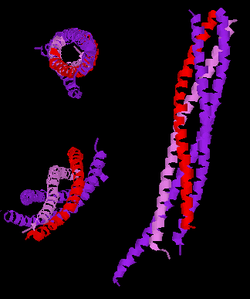
| 3 verschiedene Ansichten der Struktur eines abgekürzten neuronalen SNARE Komplexes. Legende: Synaptobrevin-2 (rot), Syntaxin-1 (rosa), SNAP-25 (violett). Nach PDB 1N7S | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 118 Aminosäuren | |
| Sekundär- bis Quartärstruktur | single pass Typ 4 Membranprotein | |
| Isoformen | 3 (1A, 1B, ?) | |
| Bezeichner | ||
| Gen-Namen | VAMP-1; SYB-1 | |
| Externe IDs | OMIM: 185880 UniProt: P23763 | |
| Transporter-Klassifikation | ||
| TCDB | 1.F.1.1.1 | |
| Bezeichnung | SVF-Pore Familie | |
| Vorkommen | ||
| Homologie-Familie | Synaptobrevin | |
| Übergeordnetes Taxon | Eukaryoten | |
| Synaptobrevin-2 | ||
|---|---|---|
|
— | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 115 Aminosäuren | |
| Bezeichner | ||
| Gen-Namen | VAMP-2; SYB-2 | |
| Externe IDs | OMIM: 185881 UniProt: P63027 | |
Synaptobrevine (Isotypen 1-2) sind kleine wesentliche Membranproteine von sekretorischen Vesikeln mit einer Molekülmasse von 18 kDa. Sie gehören zur Familie der vesikel-assoziierten Membranproteinen (VAMP).
Synaptobrevin ist eines der SNARE-Proteine, die an der Bildung der SNARE-Komplexe beteiligt sind. Von den vier Alpha-Helices des SNARE-Kernkomplexes wird eine von Synaptobrevin gestellt, eine von Syntaxin und zwei von SNAP-25 (in den Neuronen).
SNARE-Proteine sind die Kernkomponenten des Molekülapparates, der die Membranverschmelzung in der Exozytose vorantreibt. Ihre Funktion wird außerdem von verschiedenen regulatorischen Proteinen, die zusammenfassend als SNARE-masters bezeichnet werden, unterstützt.
Da alle Proteine aus der VAMP/Synaptobrevin-Familie gemeinsame strukturelle Eigenschaften teilen, werden diese als R-SNAREs klassifiziert. Eine alternative Klassifizierung (V- und T-SNAREs) berücksichtigt den Ursprung der synaptobrevin-tragenden Organelle an Stelle ihrer strukturellen Eigenschaften.
Synaptobrevin spielt eine wesentliche Rolle bei der Freisetzung des Neurotransmitters Acetylcholin und der damit verbundenen Reizweiterleitung in der motorischen Endplatte von Nervenzellen. Bereits die Anwesenheit eines einzigen Moleküls von Botulinumtoxin (das stärkste bekannte Gift) kann durch dessen katalytische Wirkung das Synaptobrevin aufspalten, solange bis die betroffene Nervenzelle zerstört ist. Die angebundene Muskelfaser kann somit irreversibel nicht mehr angesteuert werden und nur durch Neubildung von Nervenzellen reaktiviert werden.
Synaptobrevin wird außerdem durch Tetanustoxin zerstört. Dieses wird nach Bagatellverletzungen von eingetretenen Tetanusbakterien produziert, von peripheren Nerven aufgenommen und retrograd ins Rückenmark transportiert.
Für seine Forschung über Synaptobrevin wurde Cesare Montecucco der Paul-Ehrlich-und-Ludwig-Darmstaedter-Preis für das Jahr 2011 zugesprochen.
Literatur
- Baumert M, Maycox PR, Navone F, De Camilli P, Jahn R (1989). Synaptobrevin: an integral membrane protein of 18,000 daltons present in small synaptic vesicles of rat brain. EMBO J 8: 379-384. PMID 2498078
- Bock JB, Scheller RH (1999). SNARE proteins mediate lipid bilayer fusion. PNAS 96: 12227-12229. PMID 10535902
- Ernst JA, Brunger AT (2003). High resolution structure, stability, and synaptotagmin binding of a truncated neuronal SNARE complex. J Biol Chem 278: 8630-8636. PMID 12496247
- Fasshauer D, Sutton RB, Brunger AT, Jahn R (1998). Conserved structural features of the synaptic fusion complex: SNARE proteins reclassified as Q- and R-SNAREs. PNAS 95: 15781-15786. PMID 9861047
- Weber T, Zemelman BV, McNew JA, Westermann B, Gmachl M, Parlati F, Sollner TH, Rothman JE (1998). SNAREpins: minimal machinery for membrane fusion. Cell 92: 759-772. PMID 9529252