Lichtsammelkomplex
Ein Lichtsammelkomplex (engl. light harvesting complex, LHC) oder Antennenkomplex (seltener auch Lichtsammelfalle) ist eine Ansammlung von Membranproteinen in den photosynthetischen Membranen von Organismen, die Photosynthese betreiben.
Funktion
Ihre Aufgabe besteht darin, Licht zu absorbieren und die Energie zum Reaktionszentrum zu leiten, wo die Lichtreaktion der Photosynthese stattfindet.
Durch die Lichtabsorption werden Elektronen in den Pigmenten in einen angeregten Zustand versetzt. Die absorbierte Energie wird über eine Vielzahl von Pigmenten zum sogenannten Reaktionszentrum geleitet. Dieser Energietransferprozess ist sehr schnell (Pikosekunden-Bereich) und extrem effizient.
Im Reaktionszentrum findet eine Ladungstrennung statt, die den ersten Schritt der eigentlichen Fotosynthese darstellt. Es ermöglicht die Umwandlung von ADP und NADP+ zu ATP und NADPH + H+, welche letztlich, in der lichtunabhängigen Reaktion der Photosynthese, zum Aufbau von Glucosemolekülen führt.
Struktur verschiedener Lichtsammelkomplexe

Die Lichtsammelkomplexe höherer Pflanzen und Algen befinden sich in der inneren Membran der Chloroplasten (Thylakoidmembran). Pflanzen besitzen eine ganze Reihe verschiedener Lichtsammelkomplexe, die alle Transmembranproteine darstellen. Sie sind den verschiedenen pflanzlichen Photosystemen zugeordnet. So heißt der Hauptkomplex (major complex), der mit dem Photosystem 1 assoziiert ist, LHC1-Komplex (light harvesting complex 1), der mit Photosystem 2 assoziierte Komplex LHC2. Letzterer stellt den, was die Anzahl angeht, häufigsten Lichtsammelkomplex der Welt dar und gehört aufgrund der Verbreitung von Pflanzen und Algen zu den häufigsten Proteinen überhaupt. Neben den Hauptkomplexen gibt es verschiedene weitere Lichtsammelkomplexe (minor complexes), die ebenfalls um die Photosysteme angeordnet sind. Diese werden meist mit CP und ihrem Gewicht in Kilodalton angegeben, z.B. CP29. Die Abbildung zeigt die Struktur des LHC2-Komplexes bei Blickrichtung auf die Thylakoidmembran. Die Pigmente Chlorophyll a (grün), Chlorophyll b (cyan) und verschiedene Carotinoide (gelb) werden nicht-kovalent von einem Proteingerüst (grau-transparent) gebunden. Der LHC2-Komplex hat in dieser Ansicht einen Durchmesser von 7,3 nm. Er besteht aus drei gleichen Monomeren der Größe 3,0 nm x 5,0 nm, zu je 8 Chlorophyllen a, 6 Chlorophyllen b , 2 Lutein , 1 Neoxanthin , 1 Xanthophyllzykluspigment (Violaxanthin, Antheraxanthin oder Zeaxanthin) und ca. 232 Aminosäuren.
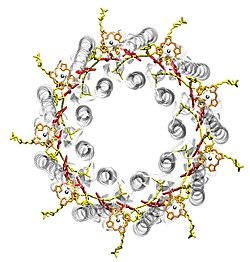
Bei Purpurbakterien sind die Lichtsammelkomplexe in der Plasmamembran eingebaut. Es handelt sich wie bei pflanzlichen Lichtsammelkomplexen um Transmembranproteine. Die meisten Spezies besitzen zwei Arten von Lichtsammelkomplexen, die LH1 und LH2 genannt werden. Einige Spezies besitzen zusätzlich einen LH3, andere ausschließlich LH1. Alle Komplexe haben eine ringförmige Struktur, die aus identischen Untereinheiten besteht. Die Abbildung zeigt beispielsweise den LH2-Komplex von "Rhodopseudomonas acidophila", der aus neun Untereinheiten besteht. Jede Untereinheit besteht aus zwei dicht beieinander liegenden Bakteriochlorophyllen (rot) und einem dazu um 90° gekippten weiten Bakteriochlorophyll (orange, nicht in LH1) sowie einem Carotinoid (gelb). Die Pigmente werden nicht-kovalent von zwei kurzen Proteinen (grau-transparent) gebunden. LH1 ist sehr ähnlich aufgebaut, besteht aber aus mehr Einheiten, z.B. 16. Dadurch ergibt sich ein größerer Ring in dessen Mitte sich das Reaktionszentrum befindet.
Quantenphysikalische Phänomene
Durch Femtosekunden-Spektroskopie konnte nachgewiesen werden, dass eine über den gesamten Komplex reichende stabile Quantenverschränkung von Photonen stattfindet, was die effiziente Nutzung der Lichtenergie ohne Wärmeverlust erst möglich macht. Bemerkenswert daran ist unter anderem die Temperaturstabilität des Phänomens.[1][2]
Literatur
Beugungsexperimente an LHC 2 zur Strukturauflösung: Nature: Vol 350, 130, 1991 und Nature: Vol 367, 614, 1994 ___________ Liu Z., Yan H., Wang K., Kuang T., Zhang J., Gui L., An X. & Chang W. (2004) Crystal structure of spinach major light-harvesting complex at 2.72A° resolution. Nature 428: 287–292.
Einzelnachweise
- ↑ Berkeley Lab Press Release: Untangling the Quantum Entanglement Behind Photosynthesis: Berkeley scientists shine new light on green plant secrets
- ↑ Mohan Sarovar, Akihito Ishizaki, Graham R. Fleming, K. Birgitta Whaley: Quantum entanglement in photosynthetic light harvesting complexes arXiv:quant-ph/0905.3787
Weblinks
- Zusammenfassung zu LHC730 von PSI
- Dissertation zu Lichtsammelkomplexen bei Rhodospirillum (PDF-Datei; 3,92 MB)
- Struktur von LHC
- Lichtsammelkomplex LH2 (PDF-Datei)
- Dissertation zur Kinetik der Elektronenanregung in LHCII (PDF-Datei)