NADPH-Cytochrom-P450-Oxidoreduktase
| NAPDH-Cytochrom-P450-Oxidoreduktase | ||
|---|---|---|
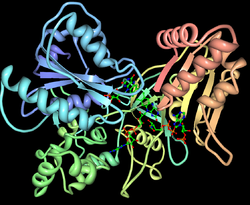
| Bändermodell der NAPDH Cytochrom P450 Reduktase (aus Hefe). Die Struktur ist aus der Fusion zweier Proteine entstanden: Flavodoxin (blau) und Ferredoxin:NADP+-Reduktase (rot/gelb). | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 680 Aminosäuren | |
| Kofaktor | Flavin-Mono-Nukleotid, Flavin-Adenin-Dinukleotid | |
| Isoformen | NP_000932.3 | |
| Bezeichner | ||
| Gen-Name | POR | |
| Externe IDs | OMIM: 124015 UniProt: P16435 | |
| Enzymklassifikation | ||
| EC, Kategorie | 1.6.2.4 Oxidoreduktase | |
| Reaktionsart | Elektronentransfer | |
| Substrat | mikrosomale Cytochrom P450 Monooxygenasen: CYP17, CYP19 | |
| Vorkommen | ||
| Übergeordnetes Taxon | Bakterien, Eukaryoten | |
NADPH-Cytochrom-P450-Oxidoreduktase (CPR), (auch NADPH-Hämoprotein-Reduktase, Genname POR) ist das Enzym, das den Elektronentransfer von NADPH/H+ auf mikrosomale Cytochrom P450-Monooxygenasen (Cyp17A1, Cyp19A1) bewirkt. CPR kommt in allen Lebewesen (außer in Archaeen) vor. In der Membran der Mikrosomen bilden CPR und CYP einen Komplex, der die Elektronen von NADPH/H+ aufnimmt und dadurch die Oxidation von beispielsweise Pregnenolon zu 17-Hydroxy-Pregnenolon mit CYP17A1, oder die Aromatisierung von Testosteron zu Estradiol durch die CYP19A1 ermöglicht.[1]
Ein Enzym als Fusionsprotein
Schon bei Bakterien gibt es die drei Funktionen der CPR: 1. Übernahme der Elektronen von NADPH/H+ durch FAD, 2. Übergabe der Elektronen an Ferredoxin/FMN, 3. Übertragung eines Elektrons auf die Hämgruppe von Cytochrom P450. Zuerst sind es getrennte Proteine, Ferredoxin-Reduktase und Ferredoxin, die sich die Aufgaben teilen. Für POR sind dann irgendwann die Gene miteinander verschmolzen..[1]
Allerdings finden sich auch schon bei Bakterien Fusionsproteine von Ferredoxin-Reduktase und Ferredoxin, die dann auch noch ein Cytochrom P450 Enzym enthalten z.B. die P450 Fettsäure-Hydroxylase P450BM3 aus Fusarium oxysporum oder Bacillus subtilis. Auch bakterielle CPR enthält das Cytochrom P450 Protein. Ein weiteres ähnliches Fusionsprotein ist auch die menschliche neuronale Nitric-Oxid-Synthase nNOS, während im Cytochrom B5-System drei Proteine angetroffen werden: NADH-Cytochrom B5-Reduktase, Cytochrom B5 eine die Desaturase.
Homologien bestehen zu einem weiteren Flavoprotein, der Sulfit-Reduktase.
Struktur und Funktion
Anders als nNOS, das im Cytosol angetroffen wird, ist CPR ein Protein des Endoplasmatischen Retikulums. Dort bildet es mit verschiedenen CYP-Monooxygenase Komplexe.
Das bei Tieren alleinige POR-Gen befindet sich beim Menschen auf Chromosom 7 Genlocus q11.2. Bei Pflanzen kommen mehrere Genkopien vor.
Die Reaktionen verschiedener Diflavin-Reduktasen, die einzelnen Transfer-Reaktionen und ihre Stereochemie, und die Interaktion mit NADPH wurden in neuerer Zeit aufgeklärt..[1]
Gendefekte von POR als Ursache von Störungen in der Nebenniere, bei der Entwicklung funktionsfähiger Geschlechtsorgane und im Knochenaufbau
Bei Patienten mit Nebennierenstörungen, Fehlbildungen der Geschlechtsorgane und Knochenmissbildungen, die dem Antley-Bixler-Syndrom entsprechen, wird häufig eine Genveränderung des POR-Gens beobachtet. Da das Genprodukt von POR für die Aktivierung aller mikrosomaler P450-Enzyme notwendig ist, werden durch Mutationen, die diese Funktionen betreffen, mehrere CYP-Enzyme in ihrer Aktivität beeinträchtigt. Unter dem Aspekt der Steroidhormonbildung sind CYP17, CYP21A2 und CYP19 betroffen. Gerade Ausfall von CYP19 führt zu verringerter Virilisierung bei männlichen und zu verstärkter Virilisierung bei weiblichen Neugeborenen. Für die Knochenentwicklung sind Androgene und Estrogene ebenfalls wichtige Regulatoren und ihr Ausfall beeinträchtigt die Entwicklung eines normalen Skeletts. Rezessive POR-Mutationen wurden bei 50 verschiedenen Patienten beobachtet. In welchem Maße POR-Defekte auch den Metabolismus mikrosomaler Leber-CYP-Monooxygenasen beeinflussen, ist noch nicht untersucht [2]
Einzelnachweise
- ↑ 1,0 1,1 1,2 Murataliev et al.: Electron transfer by diflavin reductases. In: Biochimica et Biophysica Acta. 1698, 2004, S. 1-26. doi:10.1016/j.bbapap.2003.10.003.
- ↑ Flück CE et al.: P450 Oxidoreductase Deficiency – A New Form of Congenital Adrenal Hyperplasia. In: Endocr Dev.. 13, 2008, S. 67.
Weblinks
| Bitte den Hinweis zu Gesundheitsthemen beachten! |