Isonitrile
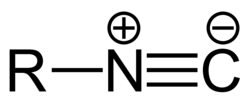
Isonitrile (ältere Benennung), bzw. Isocyanide (IUPAC-konformer Name), sind organisch-chemische Verbindungen der allgemeinen Struktur R-N≡C, wobei R ein kohlenstoffhaltiger Rest ist, wie ein Alkyl- oder Arylrest. Der Name leitet sich von den isomeren Nitrilen ab.
Herstellung
Isonitrile entstehen aus primären Aminen durch Umsetzung mit Chloroform und Alkali.[1] Sie bilden sich auch bei der Reaktion von Halogenalkanen mit Silbercyanid als Nebenprodukte der Kolbe-Nitrilsynthese.[2] Bevorzugt werden Isonitrile aus den Formamiden primärer Amine durch Wasserabspaltung mit Phosphoroxidchlorid oder p-Toluolsulfonsäurechlorid hergestellt.[3]
Eigenschaften
Isonitrile sind leichtflüchtige, sehr übelriechende, reaktive und giftige Stoffe. Sie sind isoster mit Kohlenstoffmonoxid und daher gute Komplexliganden. Die Hydrolyse von Isonitrilen ergibt Ameisensäure und primäre Amine.
Verwendung
Isonitrile sind ein Schlüsseledukt in zahlreichen Multikomponenten-Reaktionen[4], etwa in der Passerini-Reaktion, der Ugi-Reaktion und deren zahlreichen Varianten.
Einzelnachweise
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 430−431, ISBN 3-342-00280-8.
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1991, Seite 374−375, ISBN 3-7776-0485-2.
- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, Seite 596.
- ↑ J. Zhu und H. Bienaymé: Multicomponent Reactions, Wiley-VCH, 2005, ISBN 978-3-527-30806-4.