53. Oxide des Kohlenstoffs
Schädliche Nichtmetalloxide
Ein großer Teil der umweltschädlichen Emissionen sind Oxide von Nichtmetallen wie Schwefel, Stickstoff und in besonderem Maße Kohlenstoff. Diese Oxide bezeichnet man auch als "saure Oxide" oder "Säureanhydride".

Von Emissionen spricht man, wenn Stoffe aus bestimmten Quellen in die Atmosphäre gelangen. Dabei ist es egal, ob diese Stoffe aus natürlichen Quellen stammen (Ozeane, Moore, Vulkanismus) oder ob es sich um Schadstoffe handelt, die der Mensch produziert (Schornsteine, Heizungen, Autoabgase). Zu den Stoffen, die der Mensch in großem Stil in seine Umwelt emittiert gehören neben Schwefeldioxid (SO2) und Stickstoffoxiden (NOx) auch das Treibhausgas Kohlenstoffdioxid (CO2) und das giftige Kohlenstoffmonoxid (CO). Die Störung des natürlichen Gleichgewichts der Atmosphäre durch Eingriffe in den Naturhaushalt und durch Emission von Treibhausgasen verstärkt den natürlichen Treibhauseffekt und führt zur globalen Erwärmung, die ihrerseits mit zahlreichen Folgen verbunden ist.
Kohlenstoffmonoxid
Kohlenstoffmonoxid (CO) entsteht bei der unvollständigen Verbrennung von Kohlenstoff oder seinen Verbindungen, wenn nicht genügend Sauerstoff für eine komplette Verbrennung vorhanden ist. Es ist ein farbloses, brennbares und sehr giftiges Gas, das in Wasser fast unlöslich ist. Die Industrie nutzt CO als Reduktionsmittel.
Kohlenstoffmonoxid ist ein gefährliches Atemgift, da es vom Hämoglobin des Blutes an Stelle des Sauerstoffs chemisch gebunden wird und somit dem Menschen lebenswichtiges O2 vorenthält. Wenn Kohlenstoffmonoxid in großen Mengen über die Lunge in den Blutkreislauf gelangt ist, kann dies zum Tod durch Erstickung führen. Symptome einer leichten Vergiftung sind Kopfschmerzen, Schwindel und grippeähnliche Symptome. Höhere Dosen wirken hochgradig giftig auf das zentrale Nervensystem und das Herz. Als Arbeitsplatzgrenzwert (AGW - früher: MAK-Wert) gelten 30 ppm.
Kohlenstoffmonoxid ist in fast allen Verbrennungsgasen enthalten - vom Zigarettenrauch bis hin zum Wärmekraftwerk. Bei der Verbrennung entwickelt Kohlenstoffmonoxid eine große Verbrennungswärme.
Im Labor lässt sich CO durch Zersetzung von Ameisensäure herstellen:
$ \mathrm { HCOOH \quad \longrightarrow \quad CO + H_{2}O } $
Der Zerfall wird durch die wasserentziehende Wirkung konzentrierter Schwefelsäure bewirkt, die der Ameisensäure zugetropft wird.
Kohlenstoffdioxid
Kohlenstoffdioxid (CO2) ist ein unbrennbares, saures, farb- und geruchloses Gas, das sich gut in Wasser löst und eine wesentlich größere Dichte als Luft besitzt. Mit basischen Metalloxiden oder -hydroxiden bildet es zwei Arten von Salzen, die man Carbonate und Hydrogencarbonate nennt. Kohlenstoffdioxid entsteht bei Verbrennungsreaktionen, wenn genügend Sauerstoff in der Umgebung vorhanden ist:
$ \mathrm { C + O_{2} \quad \longrightarrow \quad CO_{2} + 394 \ kJ } $
Im Labor kann man CO2 durch Auftropfen von Salzsäure auf Marmor (CaCO3) gewinnen:
$ \mathrm { \underbrace {CaCO_{3} + H^{+}_{(aq)} + Cl^{-}_{(aq)} }_{\underset {\large {+ Salzsäure}} {Calciumcarbonat}} \longrightarrow \underbrace {Ca^{+}_{(aq)} + 2 Cl^{-}_{(aq)}}_{Calciumchlorid} + H_{2}O + CO_{2} \uparrow } $
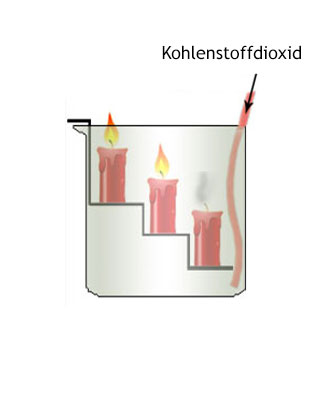
Mit Wasser reagiert Kohlenstoffdioxid in einer Gleichgewichtsreaktion unter Bildung von Kohlensäure (H2CO3):
$ \mathrm { CO_{2} + H_{2}O \leftrightharpoons H_{2}CO_{3} } $

Sprudelndes Mineralwasser mit Kohlensäure ist das Erebnis einer solchen Reaktion. In der Natur ist CO2 das Ausgangsprodukt der Photosynthese. Die vom Menschen ausgeatmete Luft enthält 4% CO2 als Produkt der Atmung in den Zellen, wobei die größte CO2- Menge von der Atmung der Mikroorganismen stammt. Demgegenüber ist der Anteil, der auf künstliche CO2- Produktion infolge technischer Prozesse zurückzuführen ist, verhältnismäßig gering.
Trübung von Kalkwasser durch Fällung von CaCO3
Bild 4 gibt einen Überblick auf den Umsatz des Kohlenstoffdioxids auf der Erde. Es ist zu sehen, dass der CO2- Gehalt der Atmosphäre geringfügig steigt. Die Folgen dieser Luftveränderung bezeichnet man heute als Treibhauseffekt oder als Globale Erwärmung.
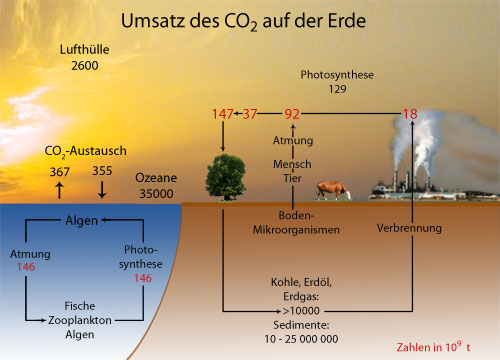
Jährlicher Umsatz des Kohlenstoffdioxids auf der Erde. Durch Atmung entstehen jährlich 8 · 1010 t Kohlenstoffdioxid.
Der größte Teil der Kohlenstoffdioxidproduktion stammt von Mikroorganismen.
Etwa 1,8 · 1010 t werden jährlich aufgrund technischer Prozesse zusätzlich in die Atmosphäre abgegeben. Schon Böger (1977) errechnete für das Jahr 2000 eine Zunahme des Kohlenstoffdioxidgehalts von 0,0378 Vol. %.
Bei Temperaturen über 1000°C wird Kohlenstoffdioxid in einer Gleichgewichtsreaktion von Kohlenstoff zu Kohlenstoffmonoxid reduziert:
$ \mathrm { 173 \ kJ + CO_{2} + C \quad \rightleftharpoons \quad 2 \ CO } $
Dieser Vorgang spielt sich beim Hochofenprozeß ab (Kapitel 57).
CO2 entsteht außerdem bei Gärungsprozessen wie der alkoholischen Gärung. Läßt man Bier längere Zeit offen stehen, verliert es seinen Geschmack. Um dies bei einem angezapften Faß zu verhindern, preßt man CO2 aus einer Stahlflasche in das Bierfaß.
Beim Einleiten von Kohlenstoffdioxid in Kalkwasser entsteht Calciumcarbonat (Trübung). Diese Reaktion dient als Nachweis für Kohlenstoffdioxid.
$ \mathrm { \underbrace {Ca^{+}_{(aq)} + 2 \ OH^{-}_{(aq)}}_{Kalkwasser} + CO_{2} \quad \longrightarrow \quad \underbrace {CaCO_{3} \downarrow \ }_{\underset {\large (weiße \ Fällung)} {Calciumcarbonat}} + H_{2}O } $
Wie Kohlenstoffdioxid in den Handel kommt
Flüssiges Kohlenstoffdioxid ist in grauen Stahlflaschen im Handel. Diese dürfen nicht dem direkten Sonnenlicht ausgesetzt oder neben Heizkörpern aufbewahrt werden (Explosionsgefahr wegen Ausdehnung!). In der Technik macht man sich Kohlenstoffdioxid als Kältemittel zunutze, denn es geht vom festen Zustand (»Trockeneis«) direkt in den gasförmigen Zustand über (Sublimation). Im Alltag kann man sublimierendes Trockeneis in Discos erleben: Die effektvollen Nebel bestehen aus sublimierendem CO2.