34. Die Ionenwanderung
Vorgänge bei der Ionenwanderung
Die Ionenwanderung (umgangssprachlicher Ausdruck) ist eine gerichtete Bewegung von Ionen in einem elektrischen Feld. Dabei wandern die negativ geladenen Anionen zur positiv geladenen Anode, während die positiven Kationen von der Kathode angezogen werden.
In der Lösung, mit der der Wollfaden in Versuch 1 getränkt wurde, befinden sich Kupfer-Ionen:
$ \mathrm { CuSO_{4} \quad \xrightarrow{H_{2}O} \quad Cu_{(aq)}^{2+} \; + \; SO_{4 \ (aq)}^{2-} } $
Kupfersulfat $\mathrm \ \longrightarrow \ \ $ Kupfer-Ion + Sulfat-Ion
und Chromat-Ionen:
$ \mathrm { K_{2}CrO_{4} \quad \xrightarrow{H_{2}O} \quad 2 \ K_{(aq)}^{+} \; + \; CrO_{4 \ (aq)}^{2-} } $
Kaliumchromat $\mathrm \longrightarrow \quad $ Kalium-Ion + Chromat-Ion
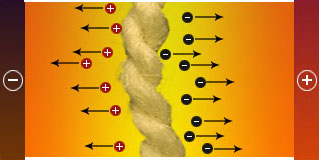
Im Versuch sind die Kupfer-Ionen an der blauen Farbe zu erkennen (die durch die Ammoniakmoleküle $ \mathrm { NH_{3} } $ des Ammoniakwassers hervorgerufen wird). Das Chromat-Ion ($ \mathrm { CrO_{4 \ (aq)}^{2-} } $) erkennt man an der gelben Farbe. Schaltet man den Gleichstrom ein, dann entspringt aus dem Wollfaden ein blauer und ein gelber Fleck, beide wandern zu jeweils einem der beiden Kupferbleche. Der gelbe Fleck wird durch die Chromat-Ionen verursacht, der blaue Fleck durch die Kupfer-Ionen.
Die Kupfer-Ionen bewegen sich zum negativen Pol (Kathode) und die Chromat-Ionen zum positiven Pol (Anode). Von dieser Beweglichkeit der Ionen stammt der Name Ion, der aus dem Griechischen kommt und sovie wie "Wandern" bedeutet. Ionen, die zur Kathode wandern heißen Kationen, sie sind positiv geladen. Ionen, die zur Anode wandern, heißen Anionen; sie sind negativ geladen.


|
||
| Kathode | Wollfaden | Anode |
|
||
Erklärung der Ionenbeweglichkeit
Beim Einschalten des Gleichstroms wird eins der Kupferbleche zur positiv geladenen Anode, das andere zur negativ geladenen Kathode. Da sowohl Kathode als auch Anode den elektrischen Strom leiten, bezeichnet man beide als Elektroden. Zwischen ihnen besteht ein elektrisches Feld. Wegen der Anziehungskräfte, die zwischen entgegengesetzten Ladungen bestehen, werden die Kationen von der negativ geladenen Kathode angezogen und umgekehrt die Anionen von der Anode. Der Stromtransport in Lösungen von Ionenverbindungen beruht also auf der Wanderung der Ionen.