35. Die Elektrolyse
In einem elektrischen Feld wandern die Ionen zu den entgegengesetzt geladenen Elektroden. Doch was passiert mit den Ionen, wenn sie die Elektroden erreicht haben? Grübel, Grübel, Grübel !!!
Geschichte
Die Elektrolyse wurde im Jahr 1800 entdeckt, wobei die von Alessandro Volta erfundene erste brauchbare Batterie verwendet wurde, die Voltasche Säule. Die neu entdeckte Elektrolyse ermöglichte es Humphry Davy, in den Jahren 1807 und 1808 mehrere unedle Metalle erstmals elementar herzustellen, beispielsweise Natrium und Calcium. Michael Faraday untersuchte die Elektrolyse genauer und entdeckte ihre Grundgesetze, nämlich die Abhängigkeit der umgesetzten Massen von der Ladungsmenge und der Molmasse. Auf seine Anregung hin wurden auch die Begriffe Elektrolyse, Elektrode, Elektrolyt, Anode, Kathode, Anion und Kation geschaffen. Nach der Erfindung leistungsfähiger elektrischer Generatoren führten Elektrolysen Ende des 19. Jahrhunderts zu einer stürmischen Entwicklung in Wissenschaft und Technik, z. B. bei der elektrolytischen Gewinnung von Aluminium, Chlor und Alkalien, und bei der Erklärung des Verhaltens der Elektrolyte, zu denen auch Säuren und Basen zählen [1].
Beobachtungen an den Elektroden
Bei Versuch 1 tauchen die Elektroden aus Graphit in eine wässrige Lösung von Zinkiodid (ZnI2). Die Glaswolle trennt den Anodenraum vom Kathodenraum, um eine zu schnelle Vermischung der Flüssigkeit im U-Rohr zu verhindern. Nachdem der Strom eingeschaltet wurde, scheidet sich an der Kathode allmählich eine bartähnliche, graue und manchmal metallisch glänzende Substanz ab.
An der Anode bilden sich braune, immer dichter werdende Wolken und schon nach kurzer Zeit (einige Minuten) ist der Anodenraum durch die braunen Schwaden undurchsichtig geworden.
Erklärung der chemischen Vorgänge
Eine Zinkiodidlösung erhält man durch überschüssige Zugabe von Zinkpulver und Iodpulver in Wasser. Nach Abklingen der Reaktion wird filtriert. Das Zinkiodid löst sich in Wasser:
$ \mathrm { ZnI_{2} \quad \xrightarrow{H_{2}O} \quad Zn_{(aq)}^{2+} \; + \; 2 \ I_{(aq)}^{-} } $
Zinkiodid $\longrightarrow \ \ \ $ Zink-Ion $\mathrm {\ \ + \ \ } $ Iodid-Ion
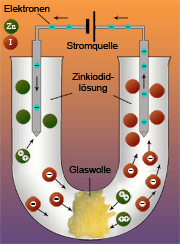
Im elektrischen Feld wandern die Zinkionen an die Kathode und die Iodionen an die Anode. Die Spannungsquelle bewirkt einen Elektronenmangel in der mit dem Pluspol (Anode) verbundenen Elektrode und einen Elektronenüberschuss in der anderen, mit dem Minuspol (Kathode) verbundenen Elektrode. Die Zinkiodidlösung zwischen der Kathode und der Anode enthält positiv und negativ geladene Ionen. Die positiv geladenen Zinkionen (Kationen) nehmen an der Kathode Elektronen auf, die negativ geladenen Iodionen geben an der Anode Elektronen ab.
Zum besseren Verständnis kann man sich die Spannungsquelle als eine »Elektronenpumpe« vorstellen, die in die Kathode Elektronen hineinpumpt und aus der Anode Elektronen absaugt. Sobald die positiv geladenen Ionen an der Kathode angelangt sind, nehmen sie je nach Ladung ein oder mehrere Elektronen auf. Die Anionen geben die Elektronen an die Anode ab, die sie bei der Ionenbildung aufgenommen haben. Die Menge der an der Anode übertragenen Elektronen ist gleich der an der Kathode übertragenen.
Elektrolyse von Zinkiodid nach Versuch 1 - Aufstellen der Reaktionsgleichung
Die Elektrolyse von Zinkiodid zerlegt dieses in die Elemente Zink und Iod. Wie alle Elektrolysen besteht auch diese aus zwei Teilreaktionen, die an den beiden Elektroden (Kathoden- und Anodenraum) ablaufen. Die Reaktionen an den einzelnen Elektrodenräumen lauten:
Kathode:
$ \mathrm { Zn^{2+} + 2 \ e^{-} \ \longrightarrow \ Zn } $
Zink-Ion Zink-Atom
Anode:
$ \mathrm { 2 \ I^{-} \ \longrightarrow \ 2 \ I + \ 2 \ e^{-} } $
Iodid-Ion Iod-Atom
Durch die Energiezufuhr bewegen sich die einzelnen Ionen in Richtung Elektroden. Die Zink-Kationen wandern zur Kathode, es werden von den Zink-Kationen zwei Elektronen aufgenommen (Reduktion) und es bildet sich elementares Zink. Die Iod-Anionen wandern zur Anode und werden zu elementarem Iod oxidiert.
In beiden Fällen werden also die Ionen durch den elektrischen Strom entladen. Die Elektrodenvorgänge können dann formuliert werden. (Die Hydrathülle der Ionen beeinflußt die Entladungsvorgänge nicht, auf sie kann bei der Formulierung der Gleichung verzichtet werden).
Da sich Iodatome sofort zu Iodmolekülen verbinden, lautet die Reaktionsgleichung für den Gesamtvorgang:
$ \mathrm { Zn^{2+} + \ 2 \ I^{-} \ \longrightarrow \ Zn + I_{2} } $
Zink-Ion Iodid-Ion Zink Iod
Aus der Gleichung kann man ersehen, dass der Belag an der Kathode aus elementarem Zink besteht, an der Anode hat sich elementares Iod gebildet. Die Wirkung des elektrischen Stroms hat die chemische Verbindung Zinkiodid in ihre Bestandteile, die Elemente Zink und Iod zerlegt. Diese Zersetzung einer Verbindung durch den Gleichstrom nennt man Elektrolyse. Bei der Elektrolyse kommt es durch die Entladung von Ionen zur Stoffabscheidung an den beiden Elektroden. Da Salze bei der Stromleitung zersetzt werden, rechnet man sie zu den Elektrolyten.
Die Bedeutung der Elektrolyse
Bei der technischen Gewinnung von Elementen spielt die Elektrolyse eine herausragende Rolle. Beispielsweise kann man mittels Elektrolyse von Kochsalzlösung an der Anode Chlor gewinnen. Die Elektrolyse einer Schmelze von Aluminiumoxid (Al2O3) produziert an der Kathode das Leichtmetall Aluminium. In Galvanikbetrieben wird elektrolytisch versilbert, verkupfert, verchromt und vieles mehr.
| Stoff | Herstellungsmenge t (m3)/Jahr | Verkaufswert Mio. € |
|---|---|---|
| Natronlauge (wässrig) | 4.316.903 | 501 |
| Chlorgas | 5.082.913 | 421 |
| Kalilauge (wässrig) | 177.506 | 52 |
| Aluminium (unlegiert) | 279.660 | 529 |
| Aluminium (legiert) | 1.033.860 | 1.397 |
| Gold (als Halbzeug) | 91 | 901 |
| Silber (als Halbzeug) | 2.635 | 455 |
| Kupfer (raffiniert) | 553.300 | 1.629 |
| Zink (rohform, raffiniert) | 264.843 | 654 |
| Metall | Verwendet als Kathode | Verwendet als Anode | Häufige Elektrolysen |
|---|---|---|---|
| Graphit (gebrannt) | + + | + + | Schmelzflusselektrolyse (Na, Li, Ca) |
| Graphit (gebrannt) | - | + + | Aluminiumelektrolyse |
| Kohlenstoff (glatt) | - | + | Fluorherstellung |
| Platin | + | - | Perschwefelsäure |
| Eisen | + + | + | Wasserelektrolyse |
| Eisen | + | - | Schmelzflusselektrolyse (Na, Li, Ca) |
| Blei - Silberlegierung | - | + | Geringe Sauerstoffüberspannung/Brennstoffzelle |
| Blei | - | + | Elektrolyse in schwefelsaurer Lösung |
| Blei | - | + | Perchlorsäure |
| Aluminium | + | - | Zink, Cadmiumelektrolyse |
| Titan (Ru) | - | + + | Hochbeständig bei NaCl-Elektrolyse |
| Quecksilber | + | - | Alkalielektrolyse |
| Zinn + Kupfer | + | - | Organische Verbindungen |
Ausblick [1]
Die Elektrolyse, mit ihren sehr hohen Wirkungsgraden bei Stoffumwandlungen, könnte neben erneuerbaren Energien zu einem Schlüsselverfahren für die Menschheit werden, um zukünftig Strom aus erneuerbaren Energien für wichtige chemische Prozesse zu nutzen. Im Gegensatz zur Verbrennung der endlichen, fossilen Rohstoffreserven (Erdöl und Erdgas) lassen sich mit solarem Strom auch anorganische und organische Stoffumwandlungen durchführen, bei denen der Kohlendioxidausstoß nicht ansteigt.
Möglich sind die Umwandlung von Solar- oder Windenergie in Strom. Der Strom kann elektrolytisch zur Herstellung von Wasserstoff und Sauerstoff genutzt werden. Auch die Reduktion von Kohlendioxid wäre denkbar.