40. Die 1. Hauptgruppe des PSE
Alkalimetalle
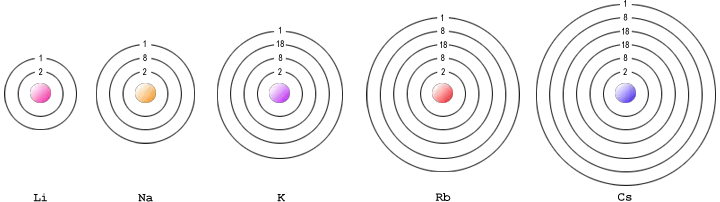
Die Alkalimetalle sind die chemischen Elemente Lithium, Natrium, Kalium, Rubidium, Caesium und Francium. Sie stehen der 1. Hauptgruppe des Periodensystems und entsprechend dieser Stellung ist ihre äußerste Elektronenschale (Valenzschale) nur mit einem einzigen Elektron besetzt. Es sind weiche Metalle, deren Schnittfläche silbrig glänzt (Metallglanz).
Eigenschaften
Alkalimetalle sind metallisch glänzende, silbrig-weiße (Ausnahme: Caesium hat bei geringster Verunreinigung einen Goldton), weiche Leichtmetalle. Sie sind mit dem Messer schneidbar. Alkalimetalle haben eine geringe Dichte. Sie reagieren mit vielen Stoffen, so beispielsweise mit Wasser, Luft oder Halogenen teilweise äußerst heftig unter starker Wärmeentwicklung.
Insbesondere die schwereren Alkalimetalle können sich an der Luft selbst entzünden. Daher werden sie unter Schutzflüssigkeiten, wie Paraffin oder Petroleum (Lithium, Natrium und Kalium) bzw. unter Luftabschluss in Ampullen (Rubidium und Caesium) aufbewahrt.
Nachweis der Alkalimetalle
Alkalimetalle und ihre Salze verursachen eine charakteristische Flammenfärbung. Diese Erscheinung kann zum Nachweis dieser Metalle bei chemischen Untersuchungen genutzt werden.
Das Verhalten zu Wasser
$ \mathrm {Natrium + Wasser \longrightarrow Natronlauge + Wasserstoff} $
$ \mathrm {Kalium + Wasser \longrightarrow \ \; Kalilauge \ \; + \; Wasserstoff} $
Die Alkalimetalle zeigen gegenüber Wasser ein scheinbar überraschendes Verhalten. Lithium, Natrium und Kalium sind so leicht, dass sie auf dem Wasser schwimmen (siehe Spalte Dichte in der Tabelle unten). Sobald sie mit Wasser in Berührung kommen tritt eine heftige chemische Reaktion ein, bei der Wasserstoff und eine Lauge entstehen. Die bei dieser Reaktion entstehende Wärme reicht aus, um die Metalle zu schmelzen.
Es handelt sich dabei um exotherme Reaktionen, die bei Kalium so viel Energie liefert, dass sich der Wasserstoff sofort entzündet. Wird beim Natrium die Bewegung auf dem Wasser gebremst, so entzündet sich auch hier der Wasserstoff.
Redoxverhalten der Alkalimetalle
Der Atombau von Natrium und Kalium erklärt das unterschiedliche Verhalten beider Elemente, so hat Natrium einen kleineren Atomradius als Kalium, weshalb die Protonen des Natriums auf das Außenelektron eine stärkere Anziehung ausüben als die des Kaliums. Je leichter aber die Elektronen aus der Atomhülle herausgerissen werden können, desto eher können sie sich an chemischen Reaktionen beteiligen. Umgekehrt wird eine chemische Reaktion auch begünstigt, je leichter Elektronen eingefangen werden können, wie es beispielsweise bei den Halogenen der Fall ist. Reaktionen zwischen Halogenen und Alkalimetallen verlaufen deshalb besonders heftig.
Die Reaktionsbereitschaft des Natriums zu Sauerstoff ist so groß, dass es sogar den im Kohlenstoffdioxid gebundenen Sauerstoff an sich reißt. Dies erfolgt unter Aufglühen und Rußabscheidung (Schwarzfärbung am Grunde des Reagenzglases).
Bei der Reaktion von Natrium mit Kohlenstoffdioxid entsteht Kohlenstoff und das Salz Natriumcarbonat:
$ \mathrm {3 \ CO_2 + 4 \ Na \longrightarrow \ 2 \ Na_2CO_3 + C} $
Kohlendioxid + Natrium → Natriumcarbonat + Kohlenstoff
Natrium entzieht also einer Verbindung den Sauerstoff. Damit ist es ist ein Reduktionsmittel, da es leicht sein Außenelektron abgibt:
$ \mathrm { \underbrace {Na}_{Natriumatom} \cdot \longrightarrow \underbrace {Na^+ + e^-}_{Natriumion} } $
| Element | Flammenfarbe | Atommasse (u) | Atomradius (nm) | Dichte | Schmelzpunkt °C | Siedepunkt °C |
|---|---|---|---|---|---|---|
| Lithium | rot | 6,9 | 0,122 | 0,53 | 179 | 1336 |
| Natrium | gelb | 22,9 | 0,157 | 0,97 | 97,9 | 883 |
| Kalium | violett | 39,1 | 0,202 | 0,86 | 63,5 | 757 |
| Rubidium | rot | 85,4 | 0,216 | 1,53 | 39,0 | 700 |
| Cäsium | bläulich-violett | 132,9 | 0,235 | 1,90 | 28,4 | 670 |
| Reaktionsfähigkeit nimmt von oben nach unten ab | ||||||
