18. Das Wasser als Lösungsmittel
Der Lösungsvorgang
In der Technik, im Haushalt und in der Natur ist Wasser mit Abstand das wichtigste Lösungsmittel. Wirft man ein Stück Zucker (ein Feststoff) in ein Glas Wasser, dann verteilen sich die Zuckermoleküle im Lösungsmittel Wasser. Nach Dalton (Dalton-Modell) vermischen sich also die Zuckermoleküle mit den Wassermolekülen.
Dabei entsteht ein einheitliches Gemisch, die Lösung. Wenn man fortwährend Zucker ins Wasser gibt, kommt schnell der Punkt, wo sich der Zucker nicht mehr auflöst und wir eine gesättigte Lösung erhalten haben. Der ungelöste Feststoff Zucker, der sich nun am Boden des Gefäßes befindet, bezeichnet man als Bodenkörper.
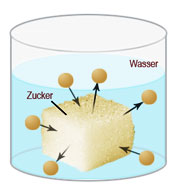
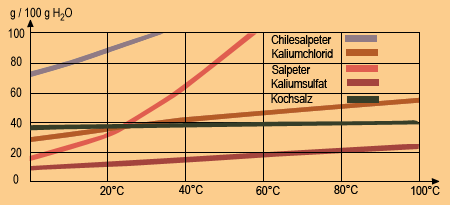
Die Masse eines Stoffes, die sich in einem bestimmten Volumen eines Lösungsmittels gerade noch löst, wird Löslichkeit genannt. Sie ist von der Temperatur des Lösungsmittels abhängig (Abb. 18.3). Bei der Lösung spielt die Wärmebewegung der Lösungsmittelteilchen und der Feststoffteilchen eine Rolle. Sie führt zur langsamen Durchmischung beider Stoffe (Diffusion).
Eine Beschleunigung des Lösungsvorgangs kann man durch Umrühren erreichen. Beim Auflösen eines Stoffes kann Erwärmung (Lösungswärme positiv) oder Abkühlung (Lösungswärme negativ) eintreten. Die Lösungswärme einiger Stoffe zeigt die Tabelle unten.
| Ätznatron | + 42,32 kJ |
| Schwefelsäure | + 74,58 kJ |
| Soda, wasserfrei | + 23,56 kJ |
| Calciumchlorid, wasserfrei |
+ 75,42 kJ |
| Ammoniumchlorid | - 15,92 kJ |
| Kochsalz | - 4,020 kJ |
| Kristallsoda | - 67,88 kJ |
| Glaubersalz |
- 77,25 kJ |
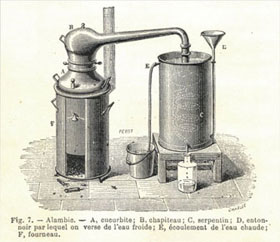
Eine Trennung von Lösungsmittel und gelöstem Stoff kann durch Verdampfen des Lösungsmittels erreicht werden (2). Der flüchtige Stoff kann vom weniger flüchtigen Stoff durch Destillieren getrennt werden (Bild 1).
Abhängigkeit der Löslichkeit von Temperatur und Druck
Die Löslichkeit der meisten Feststoffe nimmt mit steigender Temperatur des Lösungsmittels zu (Bild 3). Die Temperaturabhängigkeit des Lösungsvorgangs ist für einen Stoff typisch. Während sich die Löslichkeit von Kochsalz mit steigender Temperatur kaum ändert, nimmt die des Salpeters sehr stark zu.
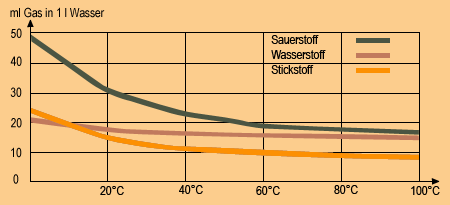
Die Lösung von Gasen in einer Flüssigkeit nennt man Absorption, die mit steigendem Druck zunimmt und mit ansteigender Temperatur abfällt. Dies ist ein allgemeingültiges Gesetz.
Die Bedeutung des Lösungsvorgangs für Lebewesen
Wasser dient in Lebewesen als Lösungsmittel für Nährstoffe und andere lebenswichtige Stoffe als Transportmittel und Wassertiere atmen den im Wasser gelösten Sauerstoff. Sie nehmen ihn mit den Kiemen oder direkt über die Haut auf.
Flüsse können sich durch das Kühlwasser von Kraftwerken oder Fabriken erwärmen, was bedeutet, dass der Sauerstoffgehalt der Flüsse sinkt (Bild 4). Um das Überleben von Wassertieren nicht zu gefährden, insbesondere das Überleben von Fischen, darf das Einleiten von Kühl- oder Abwasser die Flüsse nicht über 28°C aufwärmen. Wenn sich im Wasser Giftstoffe aus Abwässern oder als Folge von Fäulnisprozessen auflösen, kann es zu Massensterben von Fischen mit schlimmen Folgen für die Umwelt kommen.