96. Isomerie bei Alkoholen
Verschiedene Strukturen des Kohlenwasserstoffrestes
Isomerie ist das Auftreten von zwei oder mehreren chemischen Verbindungen mit gleicher Summenformel undMolekülmasse, die sich jedoch in der Verknüpfung oder der räumlichen Anordnung der Atome unterscheiden. Die entsprechenden Verbindungen werden Isomere genannt und lassen sich durch unterschiedliche Strukturformeln darstellen.
Bei den Alkoholen gibt es - wie bei den Kohlenwasserstoffen - mit zunehmender Kettenlänge zahlreiche Isomere. Die folgenden Verbindungen sind beide Pentanole, die sich aufgrund unterschiedlicher Verzweigung des Kohlenwasserstoffrestes unterscheiden.
$ \mathrm { H \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; –\ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; –\ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ OH \qquad { \color{Brown} {und} } \qquad H \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \;\;\;\; — \!\!\! { \overset {{\Large H} \ – \ {\overset {\huge H} { \overset | {\Large C}}} \ – \ {\Large H}} {\overset {|} {\underset {\Large H \ – \ {\underset {\huge H} {\underset {|}C}} \ – \ H} {\underset | C}}}} \; \!\!\!— \;\;\;\; { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|} {C}}}}} \ – \ OH } $
Die unterschiedlichen Strukturen der beiden dargestellten Verbindungen sind jedoch der Grund dafür, dass sie sich in ihren Eigenschaften unterscheiden. Daher müssen es auch zwei verschiedene Substanzen sein. Die Benennung erfolgt so: Zuerst ermittelt man die längste Kohlenstoffkette mit einer OH -Gruppe. Man sucht zunächst die längste Kohlenstoffkette, welche eine trägt. Daraus ergibt sich der Stammname des gesuchten Alkohols. Die Stellung der OH -Gruppe bzw. der Seitenketten gibt man durch Numerierung der C -Atome an. Die beiden Pentanole oben heißen also Pentanol-1 bzw. 2,2-Dimethylpropanol-1.

Verschiedene Stellungen der funktionellen Gruppe (Hydroxygruppe)
Bei Stellungsisomeren (auch Ortsisomere oder Regioisomere genannt) liegt die gleiche funktionelle Gruppe (Hydroxygruppe) an verschiedenen Positionen. Je nachdem, wieviel weitere Kohlenstoffatome mit dem Kohlenstoffatom verbunden sind, an dem die Hydroxygruppe gebunden ist, spricht man von primären, sekundären oder tertiären Alkoholen. Es gibt auch quartäre Kohlenstoffatome, jedoch keine quartären Alkohole.
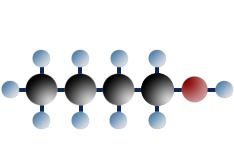
primäres Butanol (=Butanol-1)
$ \mathrm { H \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; –\ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ OH }$
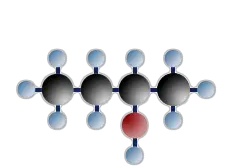
sekundäres Butanol (=Butanol-2)
$ \mathrm { H \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ { \overset {\Large H} {\overset {|} { \underset {\Large OH} {\underset {|}{C}}}}} \; –\ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ H} $
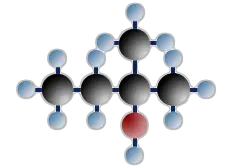
tertiäres Butanol (=2-Methylpropanol-2)
$ \mathrm { H \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \;\;\;\; — \!\!\! { \overset {{\Large H} \ – \ {\overset {\huge H} { \overset | {\Large C}}} \ – \ {\Large H}} {\overset {|} {\underset {\Large OH} {\underset | C}}}} \; \!\!\!— \;\;\;\; { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|} {C}}}}} \ – \ H } $
Das Kohlenstoffatom, das die OH - Gruppe trägt, ist mit keinem oder nur mit 1 C-Atom verbunden
An das Kohlenstoffatom, das die OH - Gruppe trägt, sind 2 C-Atome gebunden
An das Kohlenstoffatom, das die OH - Gruppe trägt, sind 3 C-Atome gebunden
Wenn man Oxidationsmittel mit den verschiedenen Alkoholen zusammenbringt, lassen sich unterschiedlichen Eigenschaften im Experiment leicht nachweisen. Primäre Alkohole, beispielsweise Ethanol und Propanol-1, werden leicht zu Aldehyden oxidiert. Wenn man sekundäre Alkohole oxidiert, erhält man Ketone:
$ \mathrm { \underbrace { H \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; \ – \ H }_{Propanol-2} + O \quad \longrightarrow \quad \underbrace { H \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ { \overset {\Large H} {\overset {|} { \underset {\Large O} {\underset {| |}{C}}}}} \; – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; \ – \ H}_{Propanon \ (=Aceton)} + H_2O } $
Tertiäre Alkohole lassen sich nicht ohne Zersetzung oxidieren.
| Name | Schmelzpunkt (°C) | Siedepunkt (°C) |
|---|---|---|
| Pentanol-1 2,2-Dimethyl-propanol-1 |
-79 -53 |
138,8 114 |
| Butanol-1 Butanol-2 2-Methylpropanol-2 |
-89 -100 -26 |
118 99 83 |